题目内容
某研究小组制备消毒液(主要成分为NaClO)设计了A、B两套装置。并查阅到下列资料,“在加热情况下,卤素和碱液发生如下反应:![]()
请回答下列问题:?
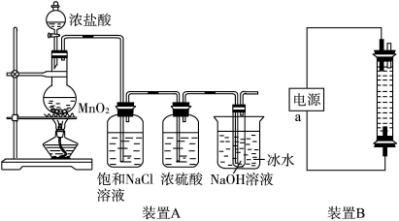
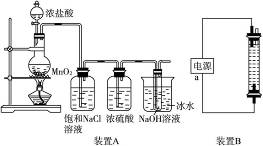
(1)装置A的大试管内发生反应的离子方程式为:________________________________。(2)装置A中能否省去盛饱和NaCl溶液的洗气瓶?理由是:____________________________。
(3)装置A中能否省去盛浓硫酸的洗气瓶?理由是:________________________________。
(4)装置A中能否省去盛冰水的烧杯?理由是:____________________________________。
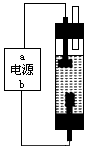
(5)装置B中制备时发生的电解反应的化学方程式为:______________________________。
(6)装置B中a端应接电源的极,理由是:________________________________________。
(1)Cl2+2OH -══Cl -+ClO -+H2O??
(2)不能,氯气中混有的HCl气体进入大试管中也会和氢氧化钠溶液反应,降低NaClO的产量和纯度??
(3)能,少量水蒸气进入试管中不影响反应?
(4)不能,氯气和水的反应是放热反应,反应温度升高时,可能引起副反应,生成NaClO3
(5)2NaCl+2H2O══H2↑+Cl2↑+2NaOH?
(6)正 产生的Cl2能充分和氢氧化钠溶液接触并发生反应
解析:装置A的气体发生装置是制备Cl2的,反应为MnO2+4HCl(浓) ![]() MnCl2+CL2↑+2H2O,气体通过饱和NaCl溶液是为了除去Cl2中的杂质气体HCl,通过浓H2SO4时是为了干燥Cl2,通入冷却的NaOH溶液则是来制备消毒液NaClO,反应为Cl2+2NaOH══NaCl+NaClO+H2O。
MnCl2+CL2↑+2H2O,气体通过饱和NaCl溶液是为了除去Cl2中的杂质气体HCl,通过浓H2SO4时是为了干燥Cl2,通入冷却的NaOH溶液则是来制备消毒液NaClO,反应为Cl2+2NaOH══NaCl+NaClO+H2O。
装置B是利用电解饱和食盐水法来制备NaClO,反应为2NaCl+2H2O![]() 2NaOH+Cl2↑+H2↑,Cl2+2NaOH══NaCl+NaClO+H2O,与a相连的下端电极上产生Cl2,为阳极,则a电极必定为正极。
2NaOH+Cl2↑+H2↑,Cl2+2NaOH══NaCl+NaClO+H2O,与a相连的下端电极上产生Cl2,为阳极,则a电极必定为正极。
问题分析:?
(1)离子方程式为:MnO2+4H ++2Cl -══Mn 2++Cl2↑+2H2O(烧瓶中)?
大试管中的是:Cl2+2OH -══ClO -+Cl -+H2O?
(2)若省去盛饱和NaCl溶液的洗气瓶,则会使HCl气体进入大试管中与NaOH溶液反应,从而使NaClO的产量降低,由于杂质NaCl增多,使NaClO的纯度也降低。?
(3)若不干燥Cl2也可以,因为少量的H2O对Cl2跟NaCl溶液的反应不会造成太大的影响。
(4)盛冰水的烧杯不能省去,因为Cl2和H2O反应是放热反应,反应温度升高时,可能引起副反应,生成NaClO3。
(5)2NaCl+2H2O![]() 2NaOH+Cl2↑+H2↑
2NaOH+Cl2↑+H2↑
(6)a极是正极,这样下端电极是阳极,电解Cl -产生Cl2,Cl2向上逸出能与NaOH溶液接触更加充分,反应生成NaClO。

 阅读快车系列答案
阅读快车系列答案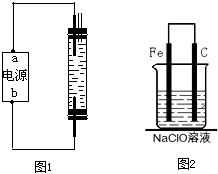 (2010?烟台一模)2008年5月12日我国四川汶川发生特大地震,为防止在大灾之后疫病流行,全国各地向灾区运送了大量的各种消毒液,如NaClO溶液.某校探究性学习小组对消毒液次氯酸钠(NaClO)的制备与性质等进行了探究.
(2010?烟台一模)2008年5月12日我国四川汶川发生特大地震,为防止在大灾之后疫病流行,全国各地向灾区运送了大量的各种消毒液,如NaClO溶液.某校探究性学习小组对消毒液次氯酸钠(NaClO)的制备与性质等进行了探究.