题目内容
【题目】A、B、C、D、E是元素周期表前四周期中的常见元素,原子序数依次增大,相关信息如下:
元素 | 相关信息 |
A | 基态原子的价电子排布式为nSnnPn |
B | 元素原子的核外p电子数比s电子数少1个 |
C | 最外层电子数是电子层数的3倍 |
D | 简单离子是第三周期元素中离子半径最小的 |
E | 价电子层中的未成对电子数为4 |
请回答下列问题:
(1)写出下列元素符号:A______, B_______,C________,D__________。
(2)写出C元素在周期表的位置_________,E2+价电子的轨道表示式______________,B元素能量最高的电子为____轨道上的电子,其轨道呈______形。
(3)按原子轨道的重叠方式,1molA与C形成的最高价化合物中σ键有______个,π键有______个。(阿伏加德罗常数的值用NA表示)
(4)B、C、D的简单离子的半径由大到小的顺序为________(用离子符号表示)。
(5)写出C的核外有18个电子的氢化物的电子式_____________。
【答案】C N O Al )第2周期第VIA族 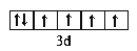 2p 纺锤形(或哑铃形) 2NA 2NA N3->O2->Al3+
2p 纺锤形(或哑铃形) 2NA 2NA N3->O2->Al3+ ![]()
【解析】
A、B、C、D、E是元素周期表前四周期中的常见元素,原子序数依次增大,由A的基态原子的价电子排布式可以知道,n=2,则A为C元素;C的最外层电子数是电子层数的3倍,则C为O元素;B的基态原子中的未成对电子数是同周期中最多的,可以知道p能级上只有3个电子,结合原子序数可以知道,B为N元素;D为简单离子是第三周期元素中离子半径最小的,则D为Al元素;E的价电子层中的未成对电子数为4,则E为Fe,据以上分析解答。
A、B、C、D、E是元素周期表前四周期中的常见元素,原子序数依次增大,由A的基态原子的价电子排布式可以知道,n=2,则A为C元素;C的最外层电子数是电子层数的3倍,则C为O元素;B的基态原子中的未成对电子数是同周期中最多的,可以知道p能级上只有3个电子,结合原子序数可以知道,B为N元素;D为简单离子是第三周期元素中离子半径最小的,则D为Al元素;E的价电子层中的未成对电子数为4,则E为Fe;
(1) 由上述分析可以知道,A为C,B为N,C为O,D为Al;综上所述,本题答案是:C,N , O ,Al。
(2)C为O,核电荷数8,在周期表的位于第2周期第VIA族;铁原子基态核外电子排布为:1s22s22p63s23p63d64s2,Fe2+价电子的轨道表示式 ;B为N, 基态核外电子排布为:1s22s22p3,能量最高的电子为2p轨道上的电子,其轨道呈纺锤形(或哑铃形);综上所述,本题答案是:第2周期第VIA族 ,
;B为N, 基态核外电子排布为:1s22s22p3,能量最高的电子为2p轨道上的电子,其轨道呈纺锤形(或哑铃形);综上所述,本题答案是:第2周期第VIA族 , ,2p; 纺锤形(或哑铃形)。
,2p; 纺锤形(或哑铃形)。
(3)按原子轨道的重叠方式,1molC与O形成的最高价化合物为CO2,结构式为O=C=O,含有σ键有2NA 个,π键有2NA 个;综上所述,本题答案是:2NA ,2NA。
(4)具有相同电子结构的离子中原子序数大的离子半径小,则B、C、D的简单离子的半径由大到小的顺序为N3->O2->Al3+;因此,本题正确答案是:N3->O2->Al3+。
(5)C的核外有18个电子的氢化物为过氧化氢,其电子式为![]() ,因此,本题正确答案是:
,因此,本题正确答案是:![]() 。
。