��Ŀ����
����Ŀ������п��һ������ɫ�뵼�壬Ҳ���������ѧ���ϣ��۵�1520�档
��1��п���ӵĵ����Ų�ʽ��_____________��
��2������Ԫ�������ɣ��縺��S______Se����һ������Se______As(�>����<������
��3��H2O�ķе�______________(�>����<����H2Se�ķе㣬��ԭ���ǣ�______��
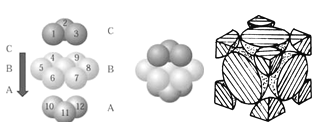
��4��NaCl������ͼ��ʾ�����������Ӷ��������ͶԳƽṹ�����Ƕ����Կ�������Բ���˴ˡ����С���������Na������λ��Ϊ____������������Ϊa pm�������ӵ�������ֵ��NA��ʾ���������ܶ�Ϊ_______g��cm��3��(�г�����ʽ����

��5��ͭ������ͭԭ�ӵĶѻ���ʽ��ͼ��ʾ��ͭ������ԭ�ӵĶѻ�ģ������_______������֪ͭ��ԭ�Ӱ뾶Ϊrcm����ʾԭ�ӿռ�ռ���ʵı���ʽΪ__________��
���𰸡�1s22s22p63s23p63d10��[Ar]3d10 < > > H2O���Ӽ������� 6 234��1030/NA��a3 ���������ѻ� ![]()
��������
(1)Zn��30��Ԫ������ԭ�Ӻ�����30����������3d��4s����Ϊ��۵���,��۵����Ų�ʽ1s22s22p63s23p63d10��[Ar]3d10����ˣ�������ȷ����:1s22s22p63s23p63d10��[Ar]3d10��
��2��ͬһ����Ԫ��,Ԫ�ص縺������ԭ�������������С,���Ե縺��S>Se��ͬһ����Ԫ�ص�һ����������ԭ���������������������,����IIA�塢��VA��Ԫ�ص�һ�����ܴ���������Ԫ��,���Ե�һ������Se<As���������������������<�� >��
(3) ����������⻯���۷е�ϸ�,H2O���������H2Se�������������H2O�ķе�(100��)����H2Se�ķе���-42�棩����ˣ�������ȷ����: > ��H2O���Ӽ���������
(4����Na��Cl��Ԫ���γɵĻ�����ΪNaCl�����м�ĺ�ɫ��ΪNa+�����о�����֮�������������6�������Ծ�����Na������λ��Ϊ6����Щ������Χ�ɵ�ͼ�����������壻������Na+������Ŀ=1+12��1/4=4��Cl-������Ŀ=8��1/8+6��1/2=4���ʾ�������=![]() g���������=[
g���������=[![]() g�¦�]cm3=
g�¦�]cm3=![]() cm3������������Ϊapm�����Ϊa3��10-30cm3����
cm3������������Ϊapm�����Ϊa3��10-30cm3����![]() =a3��10-30����=234��1030/NA��a3 g��cm��3������������������ǣ�6��234��1030/NA��a3��
=a3��10-30����=234��1030/NA��a3 g��cm��3������������������ǣ�6��234��1030/NA��a3��
(5����ͭ������ͭԭ�ӵĶѻ���ʽͼ����֪����ͭ������ԭ�ӵĶѻ�ģ���������������ܶѻ�����ͭ������ԭ�ӵĶѻ���ʽͼ����֪����ͭԭ����λ��Ϊ3��1/2��8=12��ͭԭ�Ӱ뾶Ϊrcm�������߳�Ϊ4r��![]() /2cm��ÿ��ͭ�����к���4��ԭ�ӣ���ͭԭ�ӵ����Ϊ��4��4/3��r3 cm3���������Ϊ��2
/2cm��ÿ��ͭ�����к���4��ԭ�ӣ���ͭԭ�ӵ����Ϊ��4��4/3��r3 cm3���������Ϊ��2![]() r��3���ʿռ�����������4��4/3��r3��/��2
r��3���ʿռ�����������4��4/3��r3��/��2![]() r��3=
r��3= ![]() ������������������ǣ����������ѻ���
������������������ǣ����������ѻ��� ![]() ��
��

 �ŵ������ϵ�д�
�ŵ������ϵ�д�����Ŀ���Ƶij������ϼ�Ϊ��3�ۣ��ҹ��̲��ŷḻ�ĺ��ƿ�ʯ(Y2FeBe2Si2O10)����ҵ��ͨ�������������̿ɻ�������ơ�

��֪���ٸ��������йؽ��������γ������������ʱ��pH���±���
���� | ��ʼ����ʱ��pH | ��ȫ����ʱ��pH |
Fe3�� | 2.1 | 3.1 |
Y3�� | 6.0 | 8.2 |
����Ԫ�����ڱ��У���Ԫ�غ���Ԫ�ش��ڵڶ����ں͵������ڵĶԽ���λ�ã���ѧ�������ơ�
(1)д��Na2SiO3��һ����;________________________��
(2)����Na2SiO3��Na2BeO2�����Һ���Ƶ�Be(OH)2������
�� ���ѡ�������_______�����Լ�����ͨ����Ҫ�IJ�������ʵ�֡�
A��NaOH��Һ B����ˮ C��CO2 D��HNO3
�� д��Na2BeO2���������ᷢ����Ӧ�����ӷ���ʽ___________________________��
(3)�����£���ӦFe3����3H2O(g) ![]() Fe (OH)3����3H+��ƽ�ⳣ��K= ______��ΪʹFe3��������ȫ���ð�ˮ����pH��aʱ��aӦ������_________��Χ�ڣ������Ӱ�ˮ����pH =b������Ӧ�����ӷ���ʽΪ____________________________��
Fe (OH)3����3H+��ƽ�ⳣ��K= ______��ΪʹFe3��������ȫ���ð�ˮ����pH��aʱ��aӦ������_________��Χ�ڣ������Ӱ�ˮ����pH =b������Ӧ�����ӷ���ʽΪ____________________________��
(4)���ղ�����ʱ�����ֽⷴӦ����������Ϊ�����ƣ����������ʹ����ʯ��ˮ����ǡ�д��������[Y2(C2O4)3��nH2O]���յĻ�ѧ����ʽ___________________________________��
����Ŀ��A��B��C��D��E��Ԫ�����ڱ�ǰ�������еij���Ԫ�أ�ԭ�������������������Ϣ���£�
Ԫ�� | �����Ϣ |
A | ��̬ԭ�ӵļ۵����Ų�ʽΪnSnnPn |
B | Ԫ��ԭ�ӵĺ���p��������s��������1�� |
C | �����������ǵ��Ӳ�����3�� |
D | �������ǵ�������Ԫ�������Ӱ뾶��С�� |
E | �۵��Ӳ��е�δ�ɶԵ�����Ϊ4 |
��ش��������⣺
��1��д������Ԫ�ط��ţ�A______�� B_______��C________��D__________��
��2��д��CԪ�������ڱ���λ��_________��E2+�۵��ӵĹ����ʾʽ______________,BԪ��������ߵĵ���Ϊ____����ϵĵ��ӣ�������______�Ρ�
��3����ԭ�ӹ�����ص���ʽ��1molA��C�γɵ���ۻ������ЦҼ���______�����м���______����(�����ӵ�������ֵ��NA��ʾ)
��4��B��C��D�ļ����ӵİ뾶�ɴ�С��˳��Ϊ________(�����ӷ��ű�ʾ)��
��5��д��C�ĺ�����18�����ӵ��⻯��ĵ���ʽ_____________��




