��Ŀ����
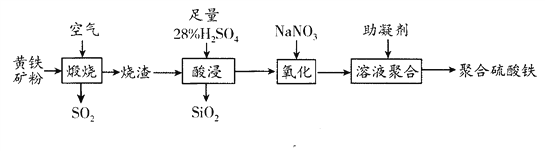
����Ŀ���ۺ���������һ������Ч��ˮ�����Ի�������Ҫ�ɷ֣�FeS2,���Ļ��ϼ�Ϊ+2�ۣ���������Ҫ�ɷ�ΪFe2O3��FeO��SiO2�ȣ�Ϊԭ����ȡ�ۺ�������(���Ļ��ϼ�Ϊ+3�ۣ���ʵ�鲽�����£�
�ش��������⣺
��1����98%��Ũ��������28%��ϡ���ᣬ��Ҫ�IJ����������������⣬����Ҫ________(��д�������ƣ���
��2�������ա����̷�����Ӧ������������___________________________��SO2����ΪSO3�ǹ�ҵ�����������Ҫ��Ӧ��д���÷�Ӧ�Ļ�ѧ����ʽ_______________________��
��3��д��������������з�����Ӧ�����ӷ���ʽ___________________________��
��4�����������������Ȳ�����ɫ���壬���ձ�ɺ���ɫ���壬д������NaNO3������ɫ���巴Ӧ�����ӷ���ʽ______________________________������H2O2����NaNO3�ﵽ��ͬ����Ч��������H2O2��NaNO3�����ʵ���֮��___________��
��5��Ϊȷ����Ʒ�Ƿ�ϸ���ⶨ�ۺ���������Fe3+��SO42�������ʵ���֮�ȣ��ⶨʱ��Ҫ���Լ�Ϊ___________ (��д��ţ���
a. FeSO4 b. BaCl2 c. NaOH d. NaCl
���𰸡� ��Ͳ���ձ� Fe2O3��SO2 2SO2 + O2![]() 2SO3 Fe2O3 +6H+=2Fe3+ +3H2O��FeO+2H+ =Fe2+ +H2O 3Fe2+ +NO3- +4H+=3Fe3+ +NO��+2H2O 3:2 bc
2SO3 Fe2O3 +6H+=2Fe3+ +3H2O��FeO+2H+ =Fe2+ +H2O 3Fe2+ +NO3- +4H+=3Fe3+ +NO��+2H2O 3:2 bc
����������1������һ��������������Һ��Ҫ�������У���Ͳ�����������ձ������Ի���Ҫ��Ͳ���ձ�����2��������֪��Ϣ��֪������������������������SO2���ɣ�Fe��S����Ԫ�صĻ��ϼ����ߣ����Է�����Ӧ������������Fe2O3��SO2��SO2����ΪSO3�ǹ�ҵ�����������Ҫ��Ӧ���÷�Ӧ�Ļ�ѧ����ʽΪ2SO2 + O2![]() 2SO3����3�������������������������ת��Ϊ�����Σ�������Ӧ�����ӷ���ʽΪFe2O3 +6H+ =2Fe3+ +3H2O��FeO+2H+ =Fe2+ +H2O����4�����������������Ȳ�����ɫ���壬���ձ�ɺ���ɫ���壬��ɫ������NO��������Ϊ����ɫ����NO2�������NaNO3������ɫ���巴Ӧ�����ӷ���ʽΪ3Fe2+ +NO3- +4H+ =3Fe3+ +NO��+2H2O��1mol˫��ˮ�õ�2mol���ӣ�1mol������õ�3mol���ӣ���������H2O2����NaNO3�����ݵ��ӵ�ʧ�غ��֪����H2O2��NaNO3�����ʵ���֮��Ϊ3:2����5�������ӿ������������Ƴ�����������������Ȼ���������ͨ���ⶨ�������������ᱵ�������������жϲ�Ʒ�Ƿ�ϸ�ѡbc��
2SO3����3�������������������������ת��Ϊ�����Σ�������Ӧ�����ӷ���ʽΪFe2O3 +6H+ =2Fe3+ +3H2O��FeO+2H+ =Fe2+ +H2O����4�����������������Ȳ�����ɫ���壬���ձ�ɺ���ɫ���壬��ɫ������NO��������Ϊ����ɫ����NO2�������NaNO3������ɫ���巴Ӧ�����ӷ���ʽΪ3Fe2+ +NO3- +4H+ =3Fe3+ +NO��+2H2O��1mol˫��ˮ�õ�2mol���ӣ�1mol������õ�3mol���ӣ���������H2O2����NaNO3�����ݵ��ӵ�ʧ�غ��֪����H2O2��NaNO3�����ʵ���֮��Ϊ3:2����5�������ӿ������������Ƴ�����������������Ȼ���������ͨ���ⶨ�������������ᱵ�������������жϲ�Ʒ�Ƿ�ϸ�ѡbc��