题目内容
【题目】2SO2(g)+O2(g) =2SO3(g)反应过程的能量变化如图所示。已知1mol SO2(g)氧化为1mol SO3的 ΔH=—99kJ·mol-1.请回答下列问题:
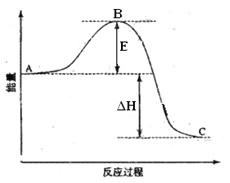
(1)图中A、C分别表示 、 ,
E的大小对该反应的反应热有无影响? 。该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低? ,理由是
(2)图中△H= KJ·mol-1;
(3)V2O5的催化循环机理可能为:V2O5氧化SO2时,自身被还原为四价钒化合物;四价钒化合物再被氧气氧化。写出该催化循环机理的化学方程式:
、
;
(4)如果反应速率υ(SO2)为0.05 mol·L-1·min-1
,则υ(O2)= mol·L-1·min-1、
υ(SO3)= mol·L-1·min-1;
(5)已知单质硫的燃烧热为296 KJ·mol-1,求由S(s)生成3 molSO3(g)的△H= 。
【答案】(1)没有影响 降低
(2)-198 (3)SO2+V2O5===SO3+2VO2,4VO2+O2===2V2O5 (4)0.025 0.05
(5)-1 185 kJ/mol
【解析】
(1)由图像可知E代表活化能,和反应热无关。催化剂能降低反应的活化能,从而加快反应速率。
(2)1 mol SO2(g)氧化为1 mol SO3(g)的ΔH=-99 kJ/mol,而方程式中二氧化硫是2mol,所以ΔH=-198 kJ/mol.
(3)根据所给元素化合价的变化可写出反应的方程式,SO2+V2O5===SO3+2VO2,4VO2+O2===2V2O5 。
(4)因为化学反应速率之比是相应的化学计量数之比,所以v(O2)=0.025mol/(L·min)、v(SO3)=0.05mol/(L·min).
(5)考查盖斯定律的应用。由反应① 2SO2(g)+O2(g)![]() 2SO3(g) ΔH=-198 kJ/mol和②S (s)+O2(g)
2SO3(g) ΔH=-198 kJ/mol和②S (s)+O2(g)![]() SO2(g) ΔH=-296 kJ/mol联立即①+②×2得2S(s)+3O2(g)
SO2(g) ΔH=-296 kJ/mol联立即①+②×2得2S(s)+3O2(g)![]() 2SO3(g) ΔH=-790 kJ/mol,所以由S(s)生成3 mol SO3(g)的ΔH=
2SO3(g) ΔH=-790 kJ/mol,所以由S(s)生成3 mol SO3(g)的ΔH=![]() 。
。

 一课一练课时达标系列答案
一课一练课时达标系列答案【题目】已知1L某待测液中除含有0.2mol·L-1的Na+外,还可能含有下列离子中的一种或几种:
阳离子 | K+、NH4+、Mg2+、Ba2+、 Fe3+ |
阴离子 | Cl-、Br-、CO32-、HCO3-、SO42- |
现进行如下实验操作(每次实验所加试剂均过量):

(1)由气体B可确定待测液中含有的离子是______________。
(2)由沉淀D和沉淀E可以判断待测液中一定含有______离子,据此可以排除的离子是________。
(3)由白色沉淀B可确定待测液中含有的离子是__________________。
(4)某同学读图后,认为待测液一定不含溴离子,他判断的依据是_________________。
(5)综合分析,待测液中K+的最小浓度为____________________。