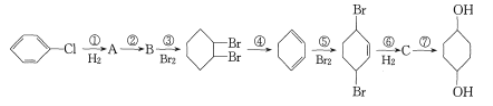
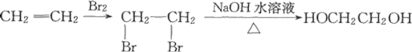题目内容
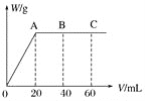
【题目】对于可逆反应A2(g)+3B2(g)![]() 2AB3(g) ΔH<0,下列图像中正确的是( )
2AB3(g) ΔH<0,下列图像中正确的是( )
A.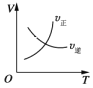 B.
B.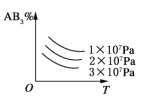
C.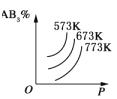 D.
D.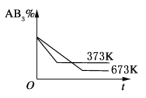
【答案】C
【解析】
对于可逆反应A2(g)+3B2(g)2AB3(g)△H<0,正反应放热,升高温度,正、逆反应速率都增大,平衡向逆反应方向移动;增大压强,平衡向正反应方向移动,结合图象分析解答。
A.升高温度,正、逆反应速率都增大,平衡向逆反应方向移动,交叉点后,逆反应速率应该大于正反应速率,故A错误;
B.该反应是气体体积减小的可逆反应,增大压强,平衡向正反应方向移动,所以生成物的含量增大,不是减小,故B错误;
C.该反应是放热反应,升高温度,平衡向逆反应方向移动,则生成物的含量减小,一定温度下,增大压强,平衡向正反应方向移动,则生成物的含量增大,故C正确;
D.温度越高,反应速率越快,到达平衡的时间越短,故D错误;
故选C。

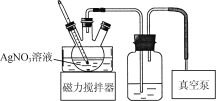
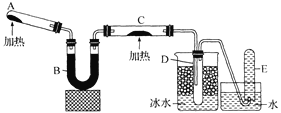
【题目】实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置)。仅用此装置和表中提供的物质完成相关实验,最合理的选项是

选项 | a中的物质 | b中的物质 | c中收集的气体 | d中的物质 |
A | 浓氨水 | CaO | NH3 | H2O |
B | 浓硫酸 | Na2SO3 | SO2 | NaOH溶液 |
C | 稀硝酸 | Cu | NO2 | H2O |
D | 浓盐酸 | MnO2 | Cl2 | NaOH溶液 |
【题目】与化学平衡类似,电离平衡的平衡常数叫作电离平衡常数(用K表示)。下表是某温度下几种常见弱酸的电离平衡常数:
酸 | 电离方程式 | 电离平衡常数 |
CH3COOH | CH3COOH | K=1.96×10-5 |
HClO | HClO | K=3.0×10-8 |
H2CO3 | H2CO3 HCO3- | K1=4.4×10-7 K2=5.6×10-11 |
H3PO4 | H3PO4 H2PO4- HPO42- | K1=7.1×10-3 K2=6.3×10-8 K3=4.2×10-13 |
回答下列问题:
(1)若把CH3COOH、HClO、H2CO3、HCO3-、H3PO4、H2PO4-、HPO42-都看作是酸,则它们酸性最强的是___(填化学式,下同),最弱的是___。
(2)向NaClO溶液中通入少量的二氧化碳,发生反应的离子方程式为___。
(3)求出该温度下,0.10mol·L-1的CH3COOH溶液中的c(H+)=____mol·L-1。
【题目】下表为某机物与对应试剂的反应现象或是否反应,则这种有机物可能是( )
试剂 | 钠 | 溴水 | NaHCO3溶液 |
现象 | 放出气体 | 褪色 | 放出气体 |
A.CH2=CH-CH2-OH
B.![]()
C.CH2=CH-COOH
D.CH3COOH