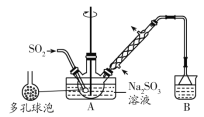
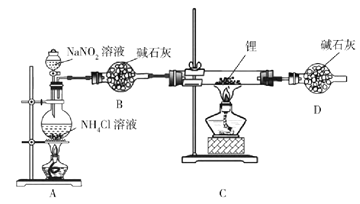
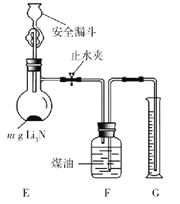
题目内容
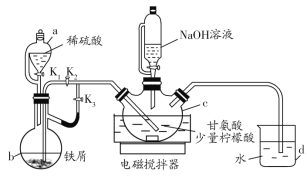
【题目】甘氨酸亚铁[(H2NCH2COO)2Fe]是一种新型补铁剂。某化学学习小组用如图所示装置(夹持仪器省略)制备甘氨酸亚铁。
有关物质性质如下表所示:
甘氨酸(H2NCH2COOH) | 易溶于水,微溶于乙醇、冰醋酸,在冰醋酸仲溶解度大于在乙醇中的溶解度。 |
柠檬酸 | 易溶于水和乙醇,酸性较强,有强还原性。 |
甘氨酸亚铁 | 易溶于水,难溶于乙醇、冰醋酸。 |
实验步骤如下:
Ⅰ.打开K1、K3,向c中通入气体,待确定c中空气被排尽后,将b中溶液加入到c中。
Ⅱ.在50℃恒温条件下用磁力搅拌器不断搅拌,然后向c中滴加NaOH溶液,调溶液pH至5.5左右,使反应物充分反应。
Ⅲ.反应完成后,向c中反应混合液中加入无水乙醇,生成白色沉淀,将沉淀过滤、洗涤得粗产品,将粗产品纯化后得精品。
回答下列问题:
(1)仪器b的名称是__,d的作用是__。
(2)步骤Ⅰ中将b中溶液加入到c中的操作是__;步骤Ⅱ中若调节溶液pH偏高,则所得粗产品中会混有杂质___(写化学式)。
(3)c中生成甘氨酸亚铁的化学方程式是__。
(4)下列关于该实验的说法错误的是__(填写序号)。
a.步骤Ⅰ中可由d中导管冒出气泡的快慢来判断装置中的空气是否排尽
b.反应混合液中加入柠檬酸的作用是防止Fe2+被氧化
c.步骤Ⅲ中加入无水乙醇的作用是降低甘氨酸亚铁的溶解度
d.步骤Ⅲ中沉淀洗涤时,用蒸馏水作洗涤剂
(5)工业上常用高氯酸在非水体系中滴定甘氨酸的方法测定产品中的甘氨酸的含量。请设计实验,将所得粗产品中的甘氨酸分离出来直接用于滴定:___。
【答案】蒸馏烧瓶 防止空气进c中将甘氨酸亚铁氧化 关闭K3,打开K2 Fe(OH)2 2H2NCH2COOH+FeSO4+2NaOH=(H2NCH2COO)2Fe+Na2SO4+2H2O ad 将粗产品置于一定量的冰醋酸中,搅拌,过滤,洗涤,得甘氨酸的冰醋酸溶液
【解析】
先打开K1、K3,铁屑与稀硫酸反应生成硫酸亚铁同时产生氢气,将装置内的空气排尽;之后关闭K3,打开K2,通过产生的气体将b中溶液压入c中;c中盛放甘氨酸和少量柠檬酸,在50℃恒温条件下用磁力搅拌器不断搅拌,然后向c中滴加NaOH溶液,调溶液pH至5.5左右,使反应物充分反应,反应完成后加入无水乙醇,降低甘氨酸亚铁的溶解度,从而使其析出;得到的产品中混有甘氨酸杂质,可用冰醋酸洗涤。
(1)根据b的结构特点可知其为蒸馏烧瓶;d中导管插入液面以下,可以形成液封,防止空气进入c中将甘氨酸亚铁氧化;
(2)关闭K3,打开K2,产生的气体可将b中溶液压入c中;pH偏高可能生成Fe(OH)2沉淀;
(3)反应物有甘氨酸、硫酸亚铁以及NaOH,已知生成物有甘氨酸亚铁,结合元素守恒可知方程式应为2H2NCH2COOH+FeSO4+2NaOH=(H2NCH2COO)2Fe+Na2SO4+2H2O;
(4)a.空气排尽后也会有氢气冒出,气泡产生的速率与空气是否排尽无关,故a错误;
b.根据题目信息可知柠檬酸具有还原性,可以防止亚铁离子被氧化,故b正确;
c.根据题目信息可知甘氨酸亚铁易溶于水,难溶于乙醇,所以加入乙醇可以降低其溶解度,使其从溶液中析出,故c正确;
d.甘氨酸亚铁易溶于水,用水洗涤会造成大量产品损失,故d错误;
综上所述选ad;
(5)甘氨酸和甘氨酸均易溶于水,但甘氨酸亚铁难溶于冰醋酸,而甘氨酸在冰醋酸中有一定的溶解度,所以可将粗产品置于一定量的冰醋酸中,搅拌,过滤,洗涤,得甘氨酸的冰醋酸溶液。

【题目】双氧水是一种重要的氧化剂、漂白剂和消毒剂。它在NCP疫情控制中发挥重要作用。
(1)工业生产双氧水常采用催化剂—乙基蒽醌法,其反应过程如图所示:

写出工业制备H2O2(1)反应的热化学方程式___。
(2)过氧化氢还可以通过电解-水解法制得。工业上用Pt作电极材料,电解硫酸氢铵饱和溶液得到过二硫酸铵[(NH4)2S2O8],然后加入适量硫酸以水解过二硫酸铵即得到过氧化氢。写出阳极的电极反应式___;整个过程的总化学方程式是___。
(3)某课题组在298K时研究H2O2+2HI=2H2O+I2反应速率的影响因素,实验结果如下表:
试验编号 | 1 | 2 | 3 | 4 | 5 |
c(HI)/mol·L-1 | 0.100 | 0.200 | 0.300 | 0.100 | 0.100 |
c(H2O2)/mol·L-1 | 0.100 | 0.100 | 0.100 | 0.200 | 0.300 |
v/mol·L-1·s-1 | 0.00760 | 0.0153 | 0.0227 | 0.0151 | 0.0228 |
分析上述数据,写出反应速率与物质浓度的关系式___;该反应的速率常数(k)的值为___。
(4)过氧化氢是强氧化剂,在许多反应中有重要的应用。在一定温度下,将0.4molN2H4(g)和0.6molH2O2(g)装入2L固定容积的容器中,发生反应N2H4(g)+2H2O2(g)![]() N2(g)+4H2O(g) ΔH<0,当N2H4(g)的转化率为50%时反应达到平衡,该反应的化学平衡常数的值为___。
N2(g)+4H2O(g) ΔH<0,当N2H4(g)的转化率为50%时反应达到平衡,该反应的化学平衡常数的值为___。
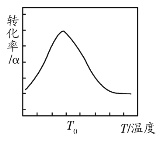
实验测得反应中N2H4(g)的转化率(α)与温度(T)的关系如图所示,分析说明温度高于T0时,N2H4(g)的转化率下降的原因是___。
【题目】下面是元素周期表的结构,用化学用语完成下列问题。
① | |||||||||||||||||
② | ③ | ④ | |||||||||||||||
⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |||||||||||||
(1)表中有编号的元素中化学性质最不活泼的,其原子结构示意图为__;④与⑤按照原子个数比1∶1形成的化合物中含有的化学键有___。
(2)①与②形成的最简单化合物的空间构型为__,将此化合物与⑧的单质混合于一干燥的集气瓶,密封后放在光亮处一段时间后,观察到的现象是__。
(3)由③形成的单质的电子式为__;⑤与⑦的最低价形成的化合物的电子式为__。
(4)⑧的最高价氧化物对应的水化物的化学式是___;①分别与④、⑦形成的简单化合物的稳定性由强到弱的顺序是__。
(5)④、⑥、⑧三种元素的原子形成的简单离子中半径由大到小的顺序是__。
(6)运用你掌握的化学理论,设计一个实验,证明⑦的非金属性比②强__(用化学方程式表示出反应原理)。