题目内容
某溶液中大量存在以下浓度的五种离子:0.4mol/L Cl﹣、0.8mol/L SO42﹣、0.2mol/L A l3+、0.6mol/L H+、M,则M及其物质的量浓度可能为( )
l3+、0.6mol/L H+、M,则M及其物质的量浓度可能为( )
A.Na+0.6mol/L B.CO32﹣ 0.2 mol/L
C.Mg2+0.4 mol/L D.Ba2+0.4mol/L
用质量分数98%、密度为1.84g·cm-3的浓硫酸配制480mL0.92mol·L-1的稀硫酸
(1)配制时,除量筒、烧杯、玻璃棒外还需玻璃仪器有 、 、 。
(2)减小误差量取时需选用合适的量筒量取 mL浓硫酸
(3)在容量瓶的使用方法中,下列操作不正确的是________。
A.使用容量瓶前检查它是否漏水 |
B.容量瓶用蒸馏水洗净后,再用待配溶液润洗 |
C.配制溶液时,如果试样是固体,把称好的试样用纸条小心倒入容量瓶中,缓慢加入蒸馏水到接近标线1~2cm处,改用胶头滴管加蒸馏水到标线 |
D.往容量瓶中转移溶液时应用玻璃棒引流 |
(4)在配制过程中,其他操作都是正确的,下列操作会引起误差偏高的是__________。
①转移溶液时不慎有少量洒到容量瓶外面 ②没有洗涤烧杯和玻璃棒③定容时俯视刻度线④容量瓶不干燥,含有少量蒸馏水⑤定容后塞上瓶塞反复摇匀,静置后,液面低于刻度线,再加水至刻度线。⑥未冷却到室温就将溶液转移到容量瓶并定容
(1)目前国际空间站处理CO2的一个重要方法是将CO2还原,所涉及的反应方程式为:CO2(g)+4H2(g) CH4(g)+2H2O(g) △H﹤0
CH4(g)+2H2O(g) △H﹤0
则升高温度平衡体系中H2的体积分数将___________;(选填“增大”、“减小”或“不变”)
(2)相同温度时,上述反应在不同起始浓度下分别达到平衡,各物质的平衡浓度如下表:
[CO2]/mol·L-1 | [H2]/mol·L-1 | [CH4]/mol·L-1 | [H2O]/mol·L-1 | |
平衡Ⅰ | a | b | c | d |
平衡Ⅱ | m | n | x | y |
a、b、c、d与m、n、x、y之间的关系式为_________。
(3)人体血液中的碳酸和碳酸氢盐存在平衡:H++ HCO3- H2CO3,当有少量酸性或碱性物质进入血液中时,血液的pH变化不大,用平衡移动原理解释上述现象。____________________
H2CO3,当有少量酸性或碱性物质进入血液中时,血液的pH变化不大,用平衡移动原理解释上述现象。____________________
(4)查阅资料获知如下信息:
i.H2CO3:Ki1=4.3×10-7,Ki2=5.6×10-11(以Ki1为主)
ii.标况下,CO2的溶解度为约为1:1
iii.H2O+CO2  H2CO3
H2CO3 
iv. 

 ㏒(6)=0.8
㏒(6)=0.8
请尝试估算:
①饱和二氧化碳溶液中碳酸的物质的量浓度c(H2CO3)约为_______________mol/L;
②饱和二氧化碳溶液中碳酸的电离度α约为_____________。
③正常雨水的pH约为____________。


 物质的量之比是 。
物质的量之比是 。 组是( )
组是( )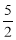 O2(g) →2CO2(g)+H2O(l) ΔH=-1300 kJ·mol-1的说法中,正确的是( )
O2(g) →2CO2(g)+H2O(l) ΔH=-1300 kJ·mol-1的说法中,正确的是( )