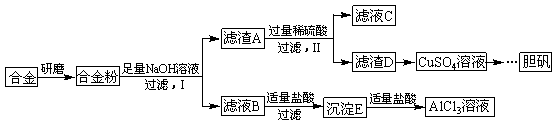
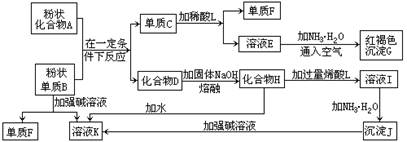
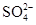题目内容
蛇纹石可用于生产氢氧化镁,简要工艺流程如下:
I.制取粗硫酸镁:用酸液浸泡蛇纹石矿粉,过滤;并在常温常压下结晶,制得粗硫酸镁(其中常含有少量Fe3+、Al3+、Fe2+等杂质离子)。
II.提纯粗硫酸镁:将粗硫酸镁在酸性条件下溶解,加入适量的0.1 mol·L-H2O2溶液,再调节溶液pH至7~8,并分离提纯。
III.制取氢氧化镁:向步骤II所得溶液中加入过量氨水。
已知:金属离子氢氧化物沉淀所需pH
请回答下列问题:
(1)步骤II中,可用于调节溶液pH至7~8的最佳试剂是 (填字母序号)。
A. MgO B. Na2CO3 C. 蒸馏水
(2)Fe2+与H2O2溶液反应的离子方程式为 。
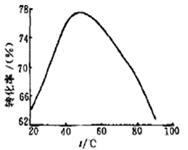
(3)工业上常以Mg2+的转化率为考察指标,确定步骤III制备氢氧化镁工艺过程的适宜条件。其中,反应温度与Mg2+转化率的关系如右图所示。
①步骤III中制备氢氧化镁反应的离子方程式为 。
②根据图中所示50 ℃前温度与Mg2+转化率之间 的关系,可判断此反应是
(填“吸热”或“放热”)反应。
③图中,温度升高至50 ℃以上Mg2+转化率下降的可能原因是 。
④ Ksp表示沉淀溶解平衡的平衡常数。已知:
Mg(OH)2(s) Mg2+ (aq)+ 2OH- (aq) Ksp = c(Mg2+)·c2(OH-) = 5.6×10-12
Mg2+ (aq)+ 2OH- (aq) Ksp = c(Mg2+)·c2(OH-) = 5.6×10-12
Ca(OH)2(s) Ca2+ (aq) + 2OH- (aq) Ksp = c(Ca2+)·c2(OH-) = 4.7×10-6
Ca2+ (aq) + 2OH- (aq) Ksp = c(Ca2+)·c2(OH-) = 4.7×10-6
若用石灰乳替代氨水, (填“能”或“不能”)制得氢氧化镁,理由是 。
I.制取粗硫酸镁:用酸液浸泡蛇纹石矿粉,过滤;并在常温常压下结晶,制得粗硫酸镁(其中常含有少量Fe3+、Al3+、Fe2+等杂质离子)。
II.提纯粗硫酸镁:将粗硫酸镁在酸性条件下溶解,加入适量的0.1 mol·L-H2O2溶液,再调节溶液pH至7~8,并分离提纯。
III.制取氢氧化镁:向步骤II所得溶液中加入过量氨水。
已知:金属离子氢氧化物沉淀所需pH
| | Fe3+ | Al3+ | Fe2+ | Mg2+ |
| 开始沉淀时 | 1.5 | 3.3 | 6.5 | 9.4 |
| 沉淀完全时 | 3.7 | 5.2 | 9.7 | 12.4 |
请回答下列问题:
(1)步骤II中,可用于调节溶液pH至7~8的最佳试剂是 (填字母序号)。
A. MgO B. Na2CO3 C. 蒸馏水
(2)Fe2+与H2O2溶液反应的离子方程式为 。
(3)工业上常以Mg2+的转化率为考察指标,确定步骤III制备氢氧化镁工艺过程的适宜条件。其中,反应温度与Mg2+转化率的关系如右图所示。

①步骤III中制备氢氧化镁反应的离子方程式为 。
②根据图中所示50 ℃前温度与Mg2+转化率之间 的关系,可判断此反应是
(填“吸热”或“放热”)反应。
③图中,温度升高至50 ℃以上Mg2+转化率下降的可能原因是 。
④ Ksp表示沉淀溶解平衡的平衡常数。已知:
Mg(OH)2(s)
 Mg2+ (aq)+ 2OH- (aq) Ksp = c(Mg2+)·c2(OH-) = 5.6×10-12
Mg2+ (aq)+ 2OH- (aq) Ksp = c(Mg2+)·c2(OH-) = 5.6×10-12Ca(OH)2(s)
 Ca2+ (aq) + 2OH- (aq) Ksp = c(Ca2+)·c2(OH-) = 4.7×10-6
Ca2+ (aq) + 2OH- (aq) Ksp = c(Ca2+)·c2(OH-) = 4.7×10-6若用石灰乳替代氨水, (填“能”或“不能”)制得氢氧化镁,理由是 。
(14分)(1)A (2分)
(2)2Fe2+ + H2O2 + 2H+ = 2Fe3+ + 2H2O (2分)
(3)① Mg2+ + 2NH3·H2O = Mg(OH)2↓ + 2NH4+ (2分)
② 吸热 (2分)
③ 温度过高时,氨水受热分解,浓度降低,Mg2+转化率下降 (2分)
④ 能, Mg(OH)2的溶解度小于Ca(OH)2,可发生沉淀的转化 (各2分)
(2)2Fe2+ + H2O2 + 2H+ = 2Fe3+ + 2H2O (2分)
(3)① Mg2+ + 2NH3·H2O = Mg(OH)2↓ + 2NH4+ (2分)
② 吸热 (2分)
③ 温度过高时,氨水受热分解,浓度降低,Mg2+转化率下降 (2分)
④ 能, Mg(OH)2的溶解度小于Ca(OH)2,可发生沉淀的转化 (各2分)
试题分析:(1)步骤II中,可用于调节溶液pH至7~8的目的是和酸反应提高溶液pH,使Fe3+、Al3+等杂质离子沉淀分离除去,
A、加入氧化镁和酸反应能提高溶液PH,生成镁离子,不加入杂质离子,可选;
B、加入碳酸钠能调节溶液PH但假如了钠离子,引入杂质,故不选;
C、蒸馏水对提高溶液pH不好,故不选;
故答案为:A;
(2)Fe2+与H2O2溶液反应亚铁离子被过氧化氢氧化为三价铁离子便于完全沉淀,过氧化氢被还原为水,反应的离子方程式为:2Fe2++H2O2+2H+═2Fe3++2H2O,
故答案为:2Fe2++H2O2+2H+═2Fe3++2H2O;
(3)①氨水沉淀镁离子生成氢氧化镁沉淀,反应的离子方程式为:Mg2++2NH3·H2O═Mg(OH)2 ↓+2NH4+,
故答案为:Mg2++2NH3·H2O═Mg(OH)2 ↓+2NH4+;
②根据图中所示50℃前温度与Mg2+转化率之间 的关系是随温度升高镁离子转化率增大,反应是吸热反应;故答案为:吸热;
③图中,温度升高至50℃以上Mg2+转化率下降的可能原因是温度过高时,氨水受热分解,浓度降低,Mg2+转化率下降,
故答案为:温度过高时,氨水受热分解,浓度降低,Mg2+转化率下降;
④依据氢氧化钙和氢氧化镁阴阳离子比相同,可以用溶度积常数比较溶解性强弱,氢氧化钙溶解性大于氢氧化镁,溶液中加入石灰乳可以实现沉淀转化,生成氢氧化镁分离出来;
故答案为:能;Mg(OH)2的溶解度小于Ca(OH)2,可发生沉淀的转化.

练习册系列答案
相关题目