题目内容
(16分)提示:某些金属氧化物跟熔融烧碱反应可生成盐。根据以下化学反应框图填空:
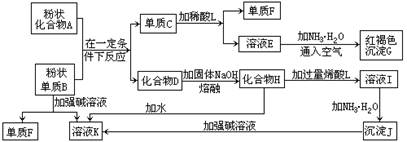
(1)单质F的化学式为 。 (2)溶液I中所含金属离子是 。
(3)由E生成G的反应类型为 , ;
A和B的混合物称为 。
(4)写出下列离子方程式: C+L ;
H转变成I ;
I转变成J ;
(5)由C→E+F若改用浓酸,则不能选用的浓酸是(写分子式) 。

(1)单质F的化学式为 。 (2)溶液I中所含金属离子是 。
(3)由E生成G的反应类型为 , ;
A和B的混合物称为 。
(4)写出下列离子方程式: C+L ;
H转变成I ;
I转变成J ;
(5)由C→E+F若改用浓酸,则不能选用的浓酸是(写分子式) 。
(1)H2 (2)Al3+和Na+ (3) 复分解反应,氧化还原反应;铝热剂
(4) Fe +2H+ Fe3++H2↑ AlO
Fe3++H2↑ AlO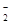 +4H+
+4H+ Al3++2H2O
Al3++2H2O
Al3++3NH3·H2O Al(OH)3↓+3NH
Al(OH)3↓+3NH (5)H2SO4(或HNO3)
(5)H2SO4(或HNO3)
(4) Fe +2H+
 Fe3++H2↑ AlO
Fe3++H2↑ AlO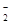 +4H+
+4H+ Al3++2H2O
Al3++2H2OAl3++3NH3·H2O
 Al(OH)3↓+3NH
Al(OH)3↓+3NH (5)H2SO4(或HNO3)
(5)H2SO4(或HNO3)试题分析:(1)中学阶段所学的能和烧碱反应产生氢气的金属单质只有铝,故单质B为铝,单质F为氢气,溶液K为四羟基合铝酸钠,红褐色沉淀G为氢氧化铁,故溶液E为含有亚铁离子的盐,故C为铁,A为铁的氧化物,D为氧化铝,化合物H为四羟基合铝酸钠固体,L为含有铝离子的盐,沉淀J为氢氧化铝;
(2)溶液I为四羟基合铝酸钠溶液,它与过量稀酸反应生成的钠盐和铝盐,故填:Na+、Al3+;
(3)亚铁盐和碱反应生成氢氧化亚铁,然后被空气迅速氧化,Fe2++2NH3?H2O=Fe(OH)2↓+2NH4+、4Fe(OH)2+O2+2H2O=4Fe(OH)3↓,依次是复分解反应,氧化还原反应;
(4)铁与稀硫酸反应生成亚铁离子:Fe +2H+
 Fe3++H2↑;
Fe3++H2↑;偏铝酸钠与过量酸反应生成的是铝离子:AlO
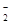 +4H+
+4H+ Al3++2H2O
Al3++2H2O硫酸铝与氨水反应生成氢氧化铝:Al3++3NH3·H2O
 Al(OH)3↓+3NH
Al(OH)3↓+3NH
(5)铁到亚铁盐不能采用强氧化性的酸,如:浓HNO3 浓H2SO4,否则将铁元素氧化到+3价;
点评:本题是一道关于元素及化合物性质的框图推断题,难度较大,要求学生具备分析和解决问题的能力。

练习册系列答案
 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案
相关题目
 Mg2+ (aq)+ 2OH- (aq) Ksp = c(Mg2+)·c2(OH-) = 5.6×10-12
Mg2+ (aq)+ 2OH- (aq) Ksp = c(Mg2+)·c2(OH-) = 5.6×10-12