题目内容
(7分)现有13克的粗锌(含杂质)与足量的稀HCl完全反应(杂质不与酸反应),生成标准状况下的H2 2.24L求:
⑴生成ZnCl2的物质的量;
⑵粗锌中含锌的质量分数。
⑴生成ZnCl2的物质的量;
⑵粗锌中含锌的质量分数。
(1)根据 可知,标准状况下的2.24LH2 的物质的量是
可知,标准状况下的2.24LH2 的物质的量是
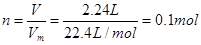 。
。
根据方程式Zn+2HCl=ZnCl2+H2↑可知
生成氯化锌是0.1mol。
(2)根据原子守恒可知,氯化锌是0.1mol
则参加反应的锌是0.1mol
根据n=m/M可知,锌的质量是0.1mol×65g/mol=6.5g
粗锌中含锌的质量分数是
 可知,标准状况下的2.24LH2 的物质的量是
可知,标准状况下的2.24LH2 的物质的量是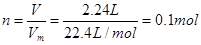 。
。根据方程式Zn+2HCl=ZnCl2+H2↑可知
生成氯化锌是0.1mol。
(2)根据原子守恒可知,氯化锌是0.1mol
则参加反应的锌是0.1mol
根据n=m/M可知,锌的质量是0.1mol×65g/mol=6.5g
粗锌中含锌的质量分数是

考查物质的量及质量分数的有关计算。主要是依据几个关系式即n=m/M、c=n/V、 等。
等。
 等。
等。
练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
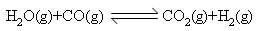 ,达到平衡后,测得CO2物质的量为0.75mol,再通入6mol水蒸气,达到新的平衡后,CO2和H2的物质的量之和为
,达到平衡后,测得CO2物质的量为0.75mol,再通入6mol水蒸气,达到新的平衡后,CO2和H2的物质的量之和为