��Ŀ����
����Ŀ����ͼ��Zn��Cu�γɵ�ԭ��أ�ijʵ����ȤС������ʵ����ڶ��鿨Ƭ�ϼ�¼���£��ڿ�Ƭ�ϣ������������ǣ� ��
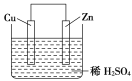
��Zn������Cu����
��H+�������ƶ�
��������������Zn�����·����Cu
��Cu������H2����
������1mol�����������ߣ������H2Ϊ0.5mol
�������ĵ缫��ӦʽΪ��Zn��2e-=Zn2+
A.�٢ڢۢ�B.�ڢۢܢ�C.�ڢܢݢ�D.�٢ڢۢ�
���𰸡�B
��������
����ͼʾ����Zn��Cu�γɵ�ԭ��أ�ԭ����л��õ缫����������Zn���������缫��ӦΪ��Zn��2e-=Zn2+��Cu���������缫��ӦΪ��2H++2e��=H2�����ݴ˷������
��һ������£�ԭ����л��ý�������������Zn���������ʢٴ���
��ԭ����У��������������ƶ�����H+�������ƶ����ʢ���ȷ
��ԭ����У����Ӿ����·�ɸ�������������������ԭ�����Zn��������ͭ������������Ӵ�Zn�����·����Cu���ʢ���ȷ��
��H+�������ƶ����������ϵõ����ӱ�Ϊ��������Cu�缫�Ϸ���2H++2e��=H2�����ʢ���ȷ��
����������Ӧ��2H++2e��=H2����֪����1mol���������ߣ����������0.5mol���ʢ���ȷ��
���ݷ����������ĵ缫��ӦʽΪ��2H++2e��=H2���������缫��ӦΪ��Zn��2e-=Zn2+���ʢ���
����������ȷ�����ڢۢܢ�����ѡB��

 ��ս�п�����ϵ�д�
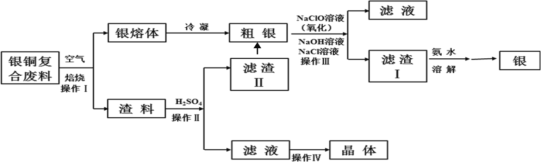
��ս�п�����ϵ�д�����Ŀ��ij����С���о���ͭ���Ϸ��ϣ������ڣ�����Ag2S�����������ʼ��Ʊ�����ͭ���壬�������£��������е��������������ϵͣ���ʵ��Ӱ��ɺ��ԣ�
��֪����AgCl�����ڰ�ˮ������[Ag(NH3)2]+��
��Ksp��Ag2SO4��=1.2��105��Ksp��AgCl��=1.8��1010��
�������к��������������������ܣ���
��1������I��Ϊ�˼ӿ�����������ʣ����Բ�ȡ_______��ʩ(д������һ�ּ���)��
��2������IV����________��_______���ˡ�ϴ�Ӻ�����Եõ�����ͭ���塣
��3��ϴ������II��������ϲ���Ŀ����__________��
��4������III�У�NaClO��Һ��Ag��Ӧ�IJ���ΪAgCl��NaOH��NaCl��O2���÷�Ӧ�Ļ�ѧ����ʽΪ______������AgCl��NaCl�����ʵ���֮��Ϊ2��1����������ͬʱ��������ת�������ӷ���ʽΪ_____����ƽ�ⳣ��K=__________��
��5���ڿ����м���5.20g����ͭ����(CuSO4��5H2O)��Ʒ�����ȹ����в�ͬ�¶ȷ�Χ�ڷֱ�õ�һ�ֹ������ʣ����������������֪CuSO4��5H2O��Է�������250��
�¶ȷ�Χ/�� | ��������/g |
200~260 | 3.33 |
650~800 | 1.67 |
1000~1500 | 1.50 |
���ȵ�1000��ʱ���������ʵĻ�ѧʽΪ��_______��
����Ŀ�����Ȼ���ͭ��CuCl��������ˮ���������������������ռ������ȼ��ȡ�
��1����һ��������CuSO4��NaCl��Һ�г�������һ��Ũ�ȵ�Na2SO3��Һ���Ƶ�CuCl�������Na2SO3��Һ�������ҺpH��ϵ��ͼ��ʾ��

�� 0 ~ 600 mLʱpH���͵�ԭ����_______�������ӷ���ʽ��ʾ����
�� 600 ~ 2000 mL�Ĺ������д̼�����ζ�������������������__________��
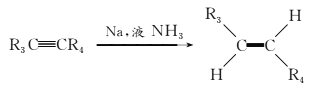
��2��CuCl����һ���Ʊ�ԭ����Cu2++Cu+2Cl����2CuCl K��5.85��106����0.01 molL��1��CuCl2��Һ�м���������ͭ��д���������˵���ܷ�����CuCl�� ________��
��3��ʹ��CuCl��CO����ķ�ӦΪCuCl(s) + xCO(g) ![]() CuClxCO(s) ��H < 0��Ϊ���CO��ƽ��ת���ʣ��ɲ�ȡ�Ĵ�ʩ��____�����ţ���
CuClxCO(s) ��H < 0��Ϊ���CO��ƽ��ת���ʣ��ɲ�ȡ�Ĵ�ʩ��____�����ţ���
A�������¶� B������ѹǿ
C���ӳ���Ӧʱ�� D����CuCl��ɢ�����ɶ�ķ���ɸ��
���Ƽ��仯������й㷺����;��
��1�������£�Ũ�Ⱦ�Ϊ0.1mol/L����������������Һ��pH���±�:
���� | CH3COONa | NaHCO3 | Na2CO3 | NaClO |
pH | 8.8 | 9.7 | 11.6 | 10.3 |
��������Һ�е������ӣ����������������ǿ����__________ �����ݱ������ݣ��������������Һ�ֱ�ϡ��100����pH�仯�����ǣ�����ţ�___________
A�� HClO B��H2CO3 C�� CH3COOH
��2������������һ�� ______������ǿ����������������ʡ�ijС��ͬѧ̽������NaClO��KAl(SO4)2��Һ��Ϸ�Ӧ��ʵ�顣��������ƿ�е�NaClO���뱥��KAl(SO4)2��Һ�����������İ�ɫ��״�������������������ԭ����______�����÷�Ӧ�����ӷ���ʽ��ʾ����
��3��ʵ�����г�����������������ϴ�����ᴿ��
��150mL 1mol/L������������Һ���ձ����2.24L������̼ʱ��������Һ�и�����Ũ���ɴ�С��˳��Ϊ��_________��