题目内容
【题目】A、B、C、D、E五种短周期元素,它们的原子序数依次增大。B原子的最外层电子数是其次外层电子数的2倍。A的一种原子中,质量数与质子数之差为零。D元素原子的最外层电子数为m,次外层电子数为n。E元素原子的L层上电子数为(m+n),M层上电子数为![]() 。请回答下列问题:
。请回答下列问题:
(1)B元素是________,D元素在周期表中的位置是________。
(2)C与E形成的化合物E3C属于________(填“原子”“离子”或“分子”)晶体。
(3)由A、D、E元素组成的化合物中存在的化学键类型是________。
(4)写出一个E和D形成的化合物与水反应的离子方程式:_________________________。
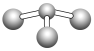
(5)已知:甲+H2O→丙+丁,该反应不是氧化还原反应。若甲是由N和Cl元素组成的化合物,其分子结构模型如下图所示,丙具有漂白性。丁与H2O有相同的电子总数,则丁的电子式为_________________。
(6)与D同主族且上下相邻的元素M、N,原子电子层数M>N>D,三种元素的氢化物的稳定性由大到小的顺序是________________________(填化学式)。
【答案】C(或碳) 第2周期ⅥA族 离子 离子键和共价键 Na2O+H2O===2Na++2OH-(或2Na2O2+2H2O===4Na++4OH-+O2↑) ![]() H2O>H2Se>H2S
H2O>H2Se>H2S
【解析】
A、B、C、D、E五种短周期元素,B原子的最外层电子数是其次外层电子数的2倍,B原子只能有2个电子层,最外层电子数为4,则B为碳元素;A的一种原子中质量数与质子数之差为零,即没有中子,则A为氢元素;D元素的原子最外层电子数为m,次外层电子数为n,E元素的原子L层电子数为m+n,M层电子数为m/2-n,则m+n=8,m<8,所以n=2,则m=8-2=6, D为氧元素;因为原子序数依次增大,所以C是氮元素;E的M层电子数=6/2-2=1,所以E为Na;所以A、B、C、D、E五种短周期元素分别是H、C、N、O、Na,以此解答该题。
(1)根据分析,B元素是碳,D元素是氧,氧元素在周期表中的位置是:第2周期ⅥA族,正确答案:碳(C);第2周期ⅥA族;
(2)C元素是N,E元素是Na,形成的化合物是Na3N,是离子化合物,属于离子晶体,正确答案:离子晶体;
(3)由A、D、E元素组成的化合物是NaOH,NaOH中存在的化学键类型是:共价键和离子键,正确答案:离子键、共价键;
(4)E和D形成的化合物为氧化钠或过氧化钠,与水反应的离子方程式为:Na2O+H2O=2Na++2OH或2Na2O2+2H2O=4Na++4OH+O2↑,故答案为:Na2O+H2O=2Na++2OH或2Na2O2+2H2O=4Na++4OH+O2↑;
(5)若甲是由N和Cl元素组成的化合物,其分子结构模型如图所示,根据其模型知,大球是Cl原子,小球是N原子,所以该物质是NCl3,丙具有漂白性,根据元素守恒知,丙是次氯酸,因为该反应是非氧化还原反应,Cl元素的化合价不变,所以甲中氯元素的化合价是+1价,丁与H2O有相同的电子总数,结合原子守恒知,丁是NH3,丁的电子式为:![]() ,正确答案:
,正确答案:![]() ;
;
(6)与D同主族上下相邻的元素M、N,原子电子层数M>N>D,则M为Se、N为S,水分子之间存在氢键,沸点最高,H2S与H2Se结构组成形式,H2Se相对分子质量较大,分子间作用力较强,H2Se沸点较H2S高,所以沸点H2O>H2Se>H2S,正确答案为:H2O>H2Se>H2S。