题目内容
【题目】氨是重要的工业原料,在农业、医药、国防和化工等领域有重要应用。
Ⅰ.常温下向100mL0.2mol·L-l的氨水中逐滴加入0.2mol·L-1的盐酸,所得溶液的pH、溶液中NH4+和NH3·H2O物质的量分数与加入盐酸的体枳的关系如图所示,根据图象回答下列问题。
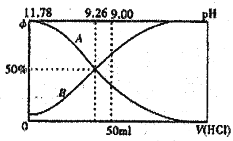
(1)表示NH3·H2O浓度变化的曲銭是____________(填“A”或“B”)。
(2)NH3·H2O的电离常数为____________(已知lg1.8=0.26)。
(3)当加入盐酸体积为50mL时,溶液中c(NH4+)·c(NH3·H2O)=____________mol·L-1(用数字表示精确值)。
Ⅱ.若液氨中也存在类似水的电离(H2O+H2O![]() H3O++OH-),碳酸钠溶于液氨后也能发生完全电离和类似水解的氨解。
H3O++OH-),碳酸钠溶于液氨后也能发生完全电离和类似水解的氨解。
(1)写出液氨的电离方程式__________________________。
(2)写出碳酸钠溶于液氨后第一级氨解的离子方程式____________________________________。
(3)写出碳酸钠的液氨溶液中各离子浓度的大小关系____________________________________。
【答案】 A 1.8×10-5或10-4.74 2×10-5-2×10-9 NH3+NH3![]() NH4++NH2- CO32-+2NH3
NH4++NH2- CO32-+2NH3![]() NH2-+NH4CO3- c(Na+)>c(CO32-)>c(NH2-)>c(NH4CO3-)>c(NH4+)
NH2-+NH4CO3- c(Na+)>c(CO32-)>c(NH2-)>c(NH4CO3-)>c(NH4+)
【解析】Ⅰ.(1)NH3·H2O加入盐酸后酸碱中和,促进了NH3·H2O的电离,NH3·H2O物质的量分数减小。
(2) 根据滴定图像,溶液pH为9.26时NH4+和NH3·H2O物质的量浓度相等,再根据电离平衡常数计算。
(3) 当加入盐酸体积为50mL时,得到等浓度的NH4Cl和NH3·H2O,再根据电荷、物料守恒进行分析。
Ⅱ.(1)仿着水的电离书写液氨的电离方程式。
(2) 类比碳酸根离子的第一步水解,碳酸钠溶于液氨后第一级氨解产生NH2-和NH4CO3-。
(3) 碳酸钠的液氨溶液中各离子浓度的大小关系类似碳酸钠的水溶液,按此进行分析。
Ⅰ.①滴定过程中NH3·H2O不断被消耗,浓度逐渐减小,表示NH3·H2O浓度变化的曲线是A;正确选项A。
②根据滴定图像,溶液pH为9.26时NH4+和NH3·H2O物质的量浓度相等,NH3·H2O的电离常数为![]() =c(OH-)=109.26-14= 10-4.74=1.8×10-5;正确答案:1.8×10-5或10-4.74 。
=c(OH-)=109.26-14= 10-4.74=1.8×10-5;正确答案:1.8×10-5或10-4.74 。
③当加入盐酸体积为50mL时,得到等浓度的NH4Cl和NH3·H2O,溶液pH=9.0,溶液中电荷守恒关系为:c(NH4+)+c(H+)=c(Cl-)+c(OH-),物料守恒关系为:c(NH4+)+c(NH3·H2O) = 2c(Cl-),两式联立得:c(NH4+)-c(NH3·H2O) =2[c(OH-)-c(H+)]=2×10-5-2×10-9;正确答案:2×10-5-2×10-9 。
Ⅱ.(1) 液氨中存在类似水的电离( H2O+H2O![]() H3O++OH-),则液氨的电离方程式为:NH3+NH3
H3O++OH-),则液氨的电离方程式为:NH3+NH3![]() NH4++ NH2-;正确答案:NH3+NH3
NH4++ NH2-;正确答案:NH3+NH3![]() NH4++NH2- 。
NH4++NH2- 。
(2)类比碳酸根离子的第一步水解,碳酸钠溶于液氨后第一级氨解产生NH2-和NH4CO3-,离子方程式为:CO32-+2NH3![]() NH2-+NH4CO3-;正确答案:CO32-+2NH3
NH2-+NH4CO3-;正确答案:CO32-+2NH3![]() NH2-+NH4CO3-。
NH2-+NH4CO3-。
(3) 根据碳酸钠溶液的水解规律,可以判断出碳酸钠的液氨溶液中各离子浓度的大小关系为:c(Na+)>c(CO32-)>c(NH2-)>c(NH4CO3-)>c(NH4+);正确答案:c(Na+)>c(CO32-)>c(NH2-)>c(NH4CO3-)>c(NH4+)。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】T K时,向2.0 L恒容密闭容器中充入1.0 mol COCl2,反应COCl2(g)![]() Cl2(g)+CO(g),经过一段时间后达到平衡。反应过程中测定的部分数据见下表:
Cl2(g)+CO(g),经过一段时间后达到平衡。反应过程中测定的部分数据见下表:
t / s | 0 | 2 | 4 | 6 | 8 |
n(Cl2) / mol | 0 | 0.16 | 0.19 | 0. 20 | 0.20 |
下列说法正确的是( )
A. 反应在前2 s 的平均速率v(CO)=0.080mol·L-1·s-1
B. 保持其他条件不变,升高温度,平衡时c(Cl2) =0.11mol·L-1,则反应的ΔH<0
C. T K时起始向容器中充入0.9 mol COCl2、0.10 mol Cl2和0.10 mol CO,达到平衡前v正>v逆
D. T K时起始向容器中充入1.0 mol Cl2和0.9 mol CO,达到平衡时,Cl2的转化率为80%



