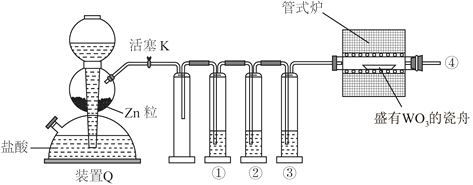
题目内容
【题目】如图所示,烧杯中都盛有稀硫酸. 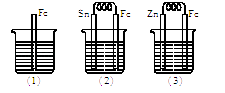
(1)中反应的离子方程式为 .
(2)中的电极反应:Fe:Sn: .
(3)中被腐蚀的金属是其电极反应式为 .
【答案】
(1)Fe+2H+=Fe2++H2↑
(2)Fe﹣2e﹣=Fe2+;2H++2e﹣=H2↑
(3)Zn;Zn﹣2e﹣=Zn2+
【解析】解:(1)中铁和稀硫酸发生置换反应生成亚铁离子和氢气,电极反应式为Fe+2H+=Fe2++H2↑,所以答案是:Fe+2H+=Fe2++H2↑;(2)该装置中Fe易失电子作负极、Sn作正极,负极电极反应为Fe﹣2e=Fe2+、正极电极反应为2H++2e=H2↑,所以答案是:Fe﹣2e=Fe2+;2H++2e=H2↑;(3)该装置中,锌易失电子作负极、Fe作正极,作原电池负极的金属易被腐蚀,所以被腐蚀的金属是Zn,电极反应为Zn﹣2e═Zn2+ , 所以答案是:Zn;Zn﹣2e═Zn2+ .

练习册系列答案
 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案
相关题目