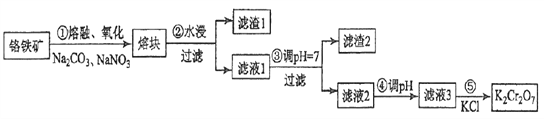
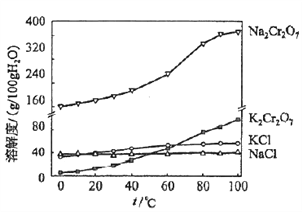
题目内容
【题目】一个完整的氧化还原反应的方程式可以拆开,写成两个“半反应式”,一个是氧化反应式,另一个是还原反应式.如2Fe3++Cu═2Fe2++Cu2+的拆写结果是:
氧化反应为Cu﹣2e﹣═Cu2+ , 还原反应为2Fe3++2e﹣═2Fe2+ , 原电池的电极反应式也可利用此方法书写.请回答下列问题: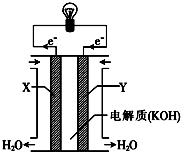
(1)已知某一反应的两个“半反应式”分别为CH4+10OH﹣﹣8e﹣═CO32﹣+7H2O和4H2O+2O2+8e﹣═8OH﹣ . 请写出该反应的总反应式:
(2)如图为氢氧燃料电池的构造示意图,已知X极的电极反应式为2H2﹣4e﹣+4OH﹣═4H2O,则X极为电池的(填“正”或“负”)极,Y极的电极反应式为 . 当电池工作一定时间后,电解质溶液的碱性(填“增强、减弱或不变”)
(3)有人以化学反应:2Zn+O2+4H+═2Zn2++2H2O为基础设计一种原电池,移入人体内作为心脏起搏器的能源,它们靠人体内血液中溶有一定浓度的O2、H+、Zn2+进行工作.则该原电池负极的电极反应式为 , 正极的电极反应式为 , 若电池工作过程中有5.6L O2(标准状况下)参于反应,则转移电子的物质的量为
【答案】
(1)CH4+2OH﹣+2O2═CO32﹣+3H2O
(2)负;O2+2H2O+4e﹣═4OH﹣;减弱
(3)2Zn﹣4e﹣═2Zn2+;O2+4H++4e﹣═2H2O;1mol
【解析】解:(1)已知甲烷燃料电池的半反应式分别为:CH4+10OH﹣﹣8e﹣═CO32﹣+7H2O,2O2+4H2O+8e﹣═8OH﹣ , 原电池中正负极电极方程式相加即可得到总反应,则总反应式:CH4+2OH﹣+2O2═CO32﹣+3H2O,所以答案是:CH4+2OH﹣+2O2═CO32﹣+3H2O;
(2.)X极的电极反应式为2H2﹣4e﹣+4OH﹣=2H2O,则通入氢气的X极为负极,发生氧化反应,并可判断溶液呈碱性,碱性溶液中正极Y极发生还原反应,电极反应为O2﹣4e﹣+2H2O=4OH﹣;氢氧燃料电池的实质是在一定条件下形成了原电池,其实质仍然是O2把H2氧化,电池总反应为2H2+O2=2H2O,生成了水将碱性溶液稀释,所以电解质溶液的碱性减弱,所以答案是:负;O2+2H2O+4e﹣═4OH﹣;减弱;
(3.)根据电池反应式知,锌失电子发生氧化反应,所以锌作负极,电极反应式为:2Zn﹣4e﹣═2Zn2+ , 氧气在正极得电子发生还原反应,电极反应式为:O2+4H++4e﹣═2H2O,若电池工作过程中有5.6L O2(标准状况下)即 ![]() =0.25mol参于反应,则转移电子的物质的量为0.25mol×4=1mol;所以答案是:2Zn﹣4e﹣═2Zn2+;O2+4H++4e﹣═2H2O;1mol.
=0.25mol参于反应,则转移电子的物质的量为0.25mol×4=1mol;所以答案是:2Zn﹣4e﹣═2Zn2+;O2+4H++4e﹣═2H2O;1mol.