题目内容
某蓄电池反应为NiO2+Fe+2H2O Fe(OH)2+Ni(OH)2。
Fe(OH)2+Ni(OH)2。
(1)该蓄电池充电时,发生还原反应的物质是 (填下列字母),放电时生成Fe(OH)2的质量18 g,则外电路中转移的电子数是 。
(2)为防止远洋轮船的钢铁船体在海水中发生电化学腐蚀,通常把船体与浸在海水里的Zn块相连,或与该蓄电池这样的直流电源的 极(填“正”或“负”)相连。
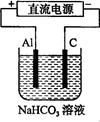
(3)以该蓄电池做电源,用右图所示装置,在实验室模拟铝制品表面“钝化”处理的过程中,发现溶液逐渐变浑浊,原因是(用相关的电极反应式和离子方程式表示)。 。
(4)精炼铜时,粗铜应与直流电源的 极(填“正”或“负”)相连,精炼过程中,电解质溶液中c(Fe2+)、c(Zn2+)会逐渐增大而影响进一步电解,甲同学设计如下除杂方案:

已知:
则加入H2O2的目的是 ,乙同学认为应将方案中的pH调节到8,你认为此观点 (填“正确”或“不正确”),理由是 。
 Fe(OH)2+Ni(OH)2。
Fe(OH)2+Ni(OH)2。(1)该蓄电池充电时,发生还原反应的物质是 (填下列字母),放电时生成Fe(OH)2的质量18 g,则外电路中转移的电子数是 。
| A.NiO2 | B.Fe | C.Fe(OH)2 | D.Ni(OH)2 |
(3)以该蓄电池做电源,用右图所示装置,在实验室模拟铝制品表面“钝化”处理的过程中,发现溶液逐渐变浑浊,原因是(用相关的电极反应式和离子方程式表示)。 。

(4)精炼铜时,粗铜应与直流电源的 极(填“正”或“负”)相连,精炼过程中,电解质溶液中c(Fe2+)、c(Zn2+)会逐渐增大而影响进一步电解,甲同学设计如下除杂方案:

已知:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | Zn(OH)2 |
| 开始沉淀时的pH | 2.3 | 7.5 | 5.6 | 6.2 |
| 完全沉淀时的pH | 3.9 | 9.7 | 6.4 | 8.0 |
则加入H2O2的目的是 ,乙同学认为应将方案中的pH调节到8,你认为此观点 (填“正确”或“不正确”),理由是 。
(1)C 0.4NA或2.408×1023(2)负
(3)Al=Al3++3e- Al3++3HCO3-=Al(OH)3↓+3CO2↑
(4)正 将Fe2+氧化为Fe3+ 不正确 因同时会使Cu2+生成沉淀而除去
(3)Al=Al3++3e- Al3++3HCO3-=Al(OH)3↓+3CO2↑
(4)正 将Fe2+氧化为Fe3+ 不正确 因同时会使Cu2+生成沉淀而除去
试题分析:(1)充电时Fe(OH)2得到电子,被还原,发生还原反应,变为Fe。内产生1mol的Fe(OH)2,转移电子2mol,现在产生Fe(OH)2的物质的量为18g÷90g/mol=0.2mol,所以转移电子的物质的量为0.4NA。(2)为防止轮船被腐蚀,应该把轮船的船体与外界电源的负极相连,这样轮船就不会失去电子,从而得到保护。(3)Al作阳极,发生反应:Al-3e-=Al3+;在溶液中发生反应:Al3++3HCO3-=Al(OH)3↓+3CO2↑。因此可看到溶液变浑浊同时冒气泡。(4)精炼铜时,粗铜应与直流电源的正极相连,精铜与直流电源的负极相连,粗铜在的Fe、Zn也逐渐被氧化变为Fe2+、Zn2+,加入H2O2可以把Fe2+氧化为Fe3+,调整溶液的PH至3.9,这时Fe3+完全为Fe(OH)3沉淀,而Cu2+仍然以离子的形式存在于溶液中。乙同学认为应将方案中的pH调节到8,你认为此观点不正确。这是因为PH=8时会使Cu2+生成沉淀而除去。

练习册系列答案
相关题目

 Cd(OH)2+2Ni(OH)2。有关该电池的说法正确的是( )
Cd(OH)2+2Ni(OH)2。有关该电池的说法正确的是( )
 a
a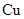 电极上发生还原反应
电极上发生还原反应