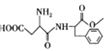
��Ŀ����
����Ŀ��[��ѧһѡ��3:���ʽṹ������]̼������п�ĵ��ʼ��仯�����й㷺��Ӧ�á�
(1)д����̬̼ԭ�ӵļ۵��ӵ����Ų�ͼ____��1mol�����Ƿ����к��ЦҼ�___����
(2)Ge��Cͬ���壬���ʲ���ȴ�ܴ�Cԭ�Ӽ�����γ�˫��������������Geԭ��֮�������γ�˫�����������ӽṹ�Ϸ�����ԭ����______________________________��
(3)�������백�����γ�������[Ni(NH3)6]2+��Ni2+��NH3֮���γɵĻ�ѧ����Ϊ____________________���ṩ�µ��ӶԵijɼ�ԭ����_____________________�����ķе�����(PH3)��ԭ����___________________��
(4)ZnO����������־���ṹ����п��ṹ���Ȼ��ƽṹ���Ȼ�綠ṹ����п��ṹ(�����ṹ����ԭ�Ӳ��������������)
������п�����������ṹ�ı����Ҫ������____________��
a.������� b.�������� c.��������
����п��ṹ��ͼ��Ʒ����Zn2+��O2-���������Ϊ__________cm��(�辧���߳�Ϊbmm)

���𰸡� ![]() 23NA Geԭ�Ӱ뾶�������γ��ȶ��Ħм��������γ�˫�������� ��λ�� N �����Ӽ��γ���� b
23NA Geԭ�Ӱ뾶�������γ��ȶ��Ħм��������γ�˫�������� ��λ�� N �����Ӽ��γ���� b ![]() ��b��10-1
��b��10-1
����������1��Cԭ�ӵ�ԭ������Ϊ6����̬Cԭ�ӵļ۵��ӵ����Ų�ͼΪ��![]() �������Ƿ��ӵĽṹʽΪ��
�������Ƿ��ӵĽṹʽΪ��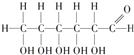 ��1mol�����Ƿ����к���23NA���Ҽ�,��Ϊ��
��1mol�����Ƿ����к���23NA���Ҽ�,��Ϊ��![]() ��23NA
��23NA
��2��Geԭ�Ӱ뾶��ԭ�Ӽ��γɵ��������ϳ���p-p����粢���ص��̶Ⱥ�С�������ص��������γ���������Ϊ��Geԭ�Ӱ뾶�������γ��ȶ��Ħм��������γ�˫��������
��3��[Ni(NH3)6]2+��Ni2+��NH3֮������λ�����ϣ��γɵĻ�ѧ����Ϊ��λ����NH3�ŶԵ���ռ��Ni2+�Ŀչ��������ṩ�µ��ӶԵijɼ�ԭ����N��NH3���Ӽ������������Ӽ�������������ۻ�������ʱ������Ҫ�˷�����ķ��Ӽ����⣬���������ع�Ӧһ���������ƻ����Ӽ����������°��ķе�����(PH3)����Ϊ����λ�� �� N �������Ӽ��γ����
��4����ZnO�����еĻ�ѧ���������Ӽ��ijɷ֣����й��ۼ��ijɷ֣����ֳɷֵĺ�����࣬���ʹ��ZnO�����еĻ�ѧ��û�����Ӿ�����ôǿ����������һ������������¸�����������ṹ�ϵĸı䡣������Zn2+��O2-��������룬���ݽṹͼ������Ҫ��һ����������Ķ��㵽���ĵľ��룬Ҳ������ͼ����AG�ľ��룬ABCD��п��G������
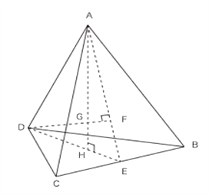
����CD�ij������p����ôAH=![]() p�� AG��GH=3��1�����İ���������ĸ߷ֳ�3��1�����ݡ��Ӿ������������������ѻ����ϵĶԽ����ǹؼ������ԣ�CD��2=�Խ��߳�=
p�� AG��GH=3��1�����İ���������ĸ߷ֳ�3��1�����ݡ��Ӿ������������������ѻ����ϵĶԽ����ǹؼ������ԣ�CD��2=�Խ��߳�=![]() �������߳�����ˣ�CD=p=
�������߳�����ˣ�CD=p=![]() b��b�Ǿ����߳���Zn2+��O2-�ľ�����AG=
b��b�Ǿ����߳���Zn2+��O2-�ľ�����AG=![]() AH=
AH=![]() ��
��![]() p =p=
p =p=![]() ��
��![]() b=
b= ![]() bmm=
bmm=![]() b
b![]() cm���� b��
cm���� b��![]() b
b![]()