题目内容
【题目】A、B、C、D、E都是短周期主族元素,原子序数依次增大,B、C同周期,A、D同主族。A、B能形成两种液态化合物甲和乙,原子个数比分别为2∶1和1∶1,E元素形成的简单离子是同周期元素中离子半径最小的。根据以上信息回答下列问题:
(1)甲、乙两分子中含有非极性共价键的物质的电子式是__________________,C元素在周期表中的位置是_________________________;
(2)C和D的离子中,半径较小的是_____________;(填离子符号)。
(3)将D的单质投入甲中,待D消失后再向上述溶液中加入E的单质,此时发生反应的离子方程式是______________________________________________________;
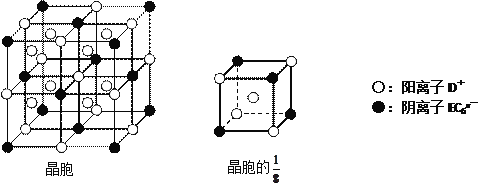
(4)C、D、E可组成离子化合物DxEC6,其晶胞(晶胞是在晶体中具有代表性的最小重复单元)结构如下图所示,阳离子D+(用○表示)位于正方体的棱的中点和正方体内部;阴离子EC6x-(用●表示)位于该正方体的顶点和面心。该化合物的化学式是___________________。
【答案】 ![]() 第二周期、第ⅦA族 Na+ 2Al+2OH-+2H2O=2AlO2-+3H2↑ Na3AlF6
第二周期、第ⅦA族 Na+ 2Al+2OH-+2H2O=2AlO2-+3H2↑ Na3AlF6
【解析】本题考查的是位置、结构和性质的关系以及应用,明确元素的推断是解答的关键,熟悉元素周期表和元素周期律即可解答。
A、B、C、D、E都是短周期主族元素,原子序数依次增大。A、B能形成两种液态化合物甲和乙,原子个数比分别为2∶1和1∶1,说明A为氢元素,B为氧元素,二者形成水和双氧水两种物质,B、C同周期,则C为氟元素,A、D同主族,则D为钠元素,E元素形成的简单离子是同周期元素中离子半径最小的,为铝元素。(1)根据以上分析,甲为水,乙为双氧水,两分子中含有非极性共价键的物质即双氧水,电子式是![]() ,C为氟元素,在周期表中的位置是第二周期、第ⅦA族。(2)氟离子和钠离子是电子层结构相同的离子,根据序小径大分析,半径较小的是Na+。(3)将钠的单质投入水中,反应生成氢氧化钠和氢气,待钠消失后再向氢氧化钠溶液中加入铝的单质,此时铝和氢氧化钠反应生成偏铝酸钠和氢气,反应的离子方程式是2Al+2OH-+2H2O=2AlO2-+3H2↑。(4)该晶胞的1/8中含有的钠离子个数为
,C为氟元素,在周期表中的位置是第二周期、第ⅦA族。(2)氟离子和钠离子是电子层结构相同的离子,根据序小径大分析,半径较小的是Na+。(3)将钠的单质投入水中,反应生成氢氧化钠和氢气,待钠消失后再向氢氧化钠溶液中加入铝的单质,此时铝和氢氧化钠反应生成偏铝酸钠和氢气,反应的离子方程式是2Al+2OH-+2H2O=2AlO2-+3H2↑。(4)该晶胞的1/8中含有的钠离子个数为![]() ,阴离子个数
,阴离子个数![]() ,所以其化学式中阴阳离子个数之比为1:3,化学式为Na3AlF6。
,所以其化学式中阴阳离子个数之比为1:3,化学式为Na3AlF6。

【题目】Ni为第Ⅷ 族元素,在许多工业生产中都有涉及。
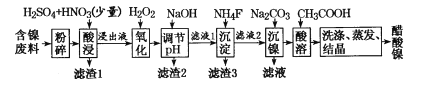
已知草酸镍晶体(NiC2O4·2H2O)难溶于水,工业上从废镍催化剂(成分主要为Ni,含有一定量的Al2O3、Fe、SiO2、CaO等)制备草酸镍晶体的流程如图所示:

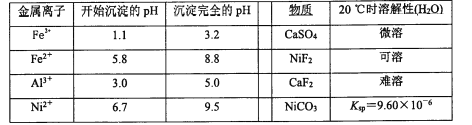
已知:①相关金属离子生成氢氧化物沉淀的pH如下表:
金属离子 | Fe3+ | Fe2+ | Al3+ | Ni2+ |
开始沉淀的pH | 1.1 | 5.8 | 3.0 | 6.8 |
完全沉淀的pH | 3.2 | 8.8 | 5.0 | 9.5 |
②Ksp(CaF2)=1.46×10-10 ③当某物质浓度小于1.0×10-5 mol/L时,视为完全沉淀
(1)请写出一种能提高酸浸速率的措施________________。
(2)试剂a是一种绿色氧化剂,写出“氧化”时反应的离子方程式__________________________。
(3)pH的调控范围为 __________________,滤渣Ⅱ的成分为_____________________________。
(4)写出“沉镍”时反应的离子方程式___________________________________________,证明Ni2+已经沉淀完全的实验步骤及现象是______________________________________,当Ca2+沉淀完全时,溶液中c(F-)>_____________ mol/L(写出计算式即可)。
(5)操作a的内容是____________________________________________。