��Ŀ����
�Ȼ�ѧ����ʽ�е�Hʵ����������ѧ�е�һ���������������ʣ�һ����ϵ���ʣ�H���ľ���ֵ��ĿǰΪֹ��û�а취��ã�������ϵ�����仯ʱ�����ǿ��Բ����ϵ���ʵı仯�����ʱ䣬�á���H����ʾ����H=H����̬��-H��ʼ̬����
��1����ѧ��Ӧ�еġ�H����
���ڻ�ѧ��ӦA+B=C+D����H��A��+H��B����H��C��+H��D������÷�Ӧ�ġ�HΪ
��2����һ���о���������ѧ��Ӧ���ʱ��뷴Ӧ���������ļ����йأ�
��֪��H2��g��+Cl2��g��=2HCl��g����H=-185kJ?mol-1����H��H2��=436kJ?mol-1��
��H��Cl2��=247kJ?mol-1�����H��HCl��=
��3��Hess G��H���ܽ����ʵ����ʵ֮����Ϊ��ֻҪ��ѧ��Ӧ��ʼ̬����̬ȷ������ѧ��Ӧ�ġ�H���Ƕ�ֵ���뷴Ӧ��;���أ�����������ġ�Hess���ɡ���
��֪��Fe2O3��s��+3CO��g��=2Fe��s��+3CO2��g����H=-25kJ?mol-1
3Fe2O3��s��+CO��g��=2Fe3O4��s��+CO2��g����H=-47kJ?mol-1
Fe3O4��s��+CO��g��=3FeO��s��+CO2��g����H=19kJ?mol-1
��д��CO��ԭFeO���Ȼ�ѧ����ʽ��
��1����ѧ��Ӧ�еġ�H����
����
����
����ʽ���ֵģ����ڻ�ѧ��ӦA+B=C+D����H��A��+H��B����H��C��+H��D������÷�Ӧ�ġ�HΪ
��
��
0������ڡ�����С�ڡ������÷�Ӧ������
����
������ȡ������ȡ�����Ӧ����2����һ���о���������ѧ��Ӧ���ʱ��뷴Ӧ���������ļ����йأ�
��֪��H2��g��+Cl2��g��=2HCl��g����H=-185kJ?mol-1����H��H2��=436kJ?mol-1��
��H��Cl2��=247kJ?mol-1�����H��HCl��=
434kJ?mol-1
434kJ?mol-1
����3��Hess G��H���ܽ����ʵ����ʵ֮����Ϊ��ֻҪ��ѧ��Ӧ��ʼ̬����̬ȷ������ѧ��Ӧ�ġ�H���Ƕ�ֵ���뷴Ӧ��;���أ�����������ġ�Hess���ɡ���
��֪��Fe2O3��s��+3CO��g��=2Fe��s��+3CO2��g����H=-25kJ?mol-1
3Fe2O3��s��+CO��g��=2Fe3O4��s��+CO2��g����H=-47kJ?mol-1
Fe3O4��s��+CO��g��=3FeO��s��+CO2��g����H=19kJ?mol-1
��д��CO��ԭFeO���Ȼ�ѧ����ʽ��
FeO��s��+CO��g���TFe��s��+CO2��g����H=-11kJ?mol-1
FeO��s��+CO��g���TFe��s��+CO2��g����H=-11kJ?mol-1
����������1����ѧ��Ӧ������һ�������������ı仯����Ӧ�ʱ���Ҫ��ָ��Ӧǰ��������仯�����������غ�����ʱ䣬����ʱ���㣺��H=H����̬��-H��ʼ̬����Hȷ����Ӧ���ȷ��ȣ���H��0Ϊ���ȷ�Ӧ����H��0Ϊ���ȷ�Ӧ��
��2����ѧ��Ӧ���ʱ��뷴Ӧ���������ļ����йأ���H=H����̬��-H��ʼ̬������������������õ���
��3�����ݸ�˹���ɵĺ��壬��ѧ��Ӧ�ġ�H���Ƕ�ֵ���뷴Ӧ��;���أ�����Ȼ�ѧ����ʽ����õ���
��2����ѧ��Ӧ���ʱ��뷴Ӧ���������ļ����йأ���H=H����̬��-H��ʼ̬������������������õ���
��3�����ݸ�˹���ɵĺ��壬��ѧ��Ӧ�ġ�H���Ƕ�ֵ���뷴Ӧ��;���أ�����Ȼ�ѧ����ʽ����õ���
����⣺��1����ѧ��Ӧ������һ�������������ı仯����Ӧ�ʱ���Ҫ��ָ��Ӧǰ��������仯�����ڻ�ѧ��ӦA+B=C+D����H��A��+H��B����H��C��+H��D������H=H����̬��-H��ʼ̬�����жϿ�֪��H��0����Ӧ�Ƿ��ȷ�Ӧ��
�ʴ�Ϊ�����ܣ�С�ڣ� ���ȣ�
��2����֪��H2��g��+Cl2��g��=2HCl��g����H=-185kJ?mol-1����H��H2��=436kJ?mol-1����H��Cl2��=247kJ?mol-1�����ݡ�H=H����̬��-H��ʼ̬����
��H=2��H��HCl��-��H��H2��-��H��Cl2��=-185kJ?mol-1�����H��HCl��=434 kJ?mol-1���ʴ�Ϊ��434 kJ?mol-1 ��
��3�����ݸ�˹����
��Fe2O3��s��+3CO��g��=2Fe��s��+3CO2��g����H=-25kJ?mol-1
��3Fe2O3��s��+CO��g��=2Fe3O4��s��+CO2��g����H=-47kJ?mol-1
��Fe3O4��s��+CO��g��=3FeO��s��+CO2��g����H=19kJ?mol-1
�١�3-�ۡ�2+�ڵõ���6FeO��s��+6CO��g���T6Fe��s��+6CO2��g����H=-66 kJ?mol-1
�õ��Ȼ�ѧ����ʽΪ��FeO��s��+CO��g���TFe��s��+CO2��g����H=-11 kJ?mol-1
�ʴ�Ϊ��FeO��s��+CO��g���TFe��s��+CO2��g����H=-11 kJ?mol-1
�ʴ�Ϊ�����ܣ�С�ڣ� ���ȣ�
��2����֪��H2��g��+Cl2��g��=2HCl��g����H=-185kJ?mol-1����H��H2��=436kJ?mol-1����H��Cl2��=247kJ?mol-1�����ݡ�H=H����̬��-H��ʼ̬����
��H=2��H��HCl��-��H��H2��-��H��Cl2��=-185kJ?mol-1�����H��HCl��=434 kJ?mol-1���ʴ�Ϊ��434 kJ?mol-1 ��
��3�����ݸ�˹����
��Fe2O3��s��+3CO��g��=2Fe��s��+3CO2��g����H=-25kJ?mol-1
��3Fe2O3��s��+CO��g��=2Fe3O4��s��+CO2��g����H=-47kJ?mol-1
��Fe3O4��s��+CO��g��=3FeO��s��+CO2��g����H=19kJ?mol-1
�١�3-�ۡ�2+�ڵõ���6FeO��s��+6CO��g���T6Fe��s��+6CO2��g����H=-66 kJ?mol-1
�õ��Ȼ�ѧ����ʽΪ��FeO��s��+CO��g���TFe��s��+CO2��g����H=-11 kJ?mol-1
�ʴ�Ϊ��FeO��s��+CO��g���TFe��s��+CO2��g����H=-11 kJ?mol-1
���������⿼���˷�Ӧ�������仯����Ӧ���ʱ���㷽�����ʱ��������ʵļ����ϵ����˹���ɵļ���Ӧ�ã���Ŀ�Ѷ��еȣ�

��ϰ��ϵ�д�
 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
�����Ŀ
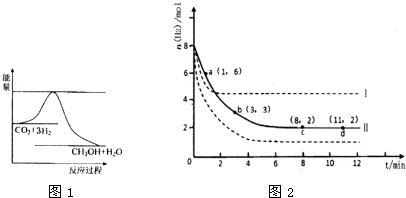
 �ڻ�ѧ��Ӧ�У�ֻ�м�����������ƽ�������ߵö�ķ�Ӧ����ӷ�����ײʱ���ܷ�����ѧ��Ӧ����������ѧ��Ӧ����ײ��֮Ϊ��Ч��ײ����Щ���ӳ�Ϊ����ӣ�ʹ��ͨ���ӱ�ɻ���������ṩ������ȵ������л�ܣ��䵥λ��kJ?mol-1��ʾ��������۲���ͼ��Ȼ��ش����⣮
�ڻ�ѧ��Ӧ�У�ֻ�м�����������ƽ�������ߵö�ķ�Ӧ����ӷ�����ײʱ���ܷ�����ѧ��Ӧ����������ѧ��Ӧ����ײ��֮Ϊ��Ч��ײ����Щ���ӳ�Ϊ����ӣ�ʹ��ͨ���ӱ�ɻ���������ṩ������ȵ������л�ܣ��䵥λ��kJ?mol-1��ʾ��������۲���ͼ��Ȼ��ش����⣮
 ��Դ����������ͷ�չ����Ҫ֧�����о�����Ч�ؿ�������Դ����Դ��ȱ�Ľ��������Ҫ���������壮
��Դ����������ͷ�չ����Ҫ֧�����о�����Ч�ؿ�������Դ����Դ��ȱ�Ľ��������Ҫ���������壮 �ڻ�ѧ��Ӧ�У���������ѧ��Ӧ�ķ��Ӽ���ײ��֮Ϊ��Ч��ײ����Щ���ӳ�Ϊ����ӣ�ʹ��ͨ���ӱ�ɻ���������ṩ����������л�ܣ��䵥λ��kJ?mol-1��ʾ��������۲�ͼ��Ȼ��ش����⣮
�ڻ�ѧ��Ӧ�У���������ѧ��Ӧ�ķ��Ӽ���ײ��֮Ϊ��Ч��ײ����Щ���ӳ�Ϊ����ӣ�ʹ��ͨ���ӱ�ɻ���������ṩ����������л�ܣ��䵥λ��kJ?mol-1��ʾ��������۲�ͼ��Ȼ��ش����⣮