题目内容
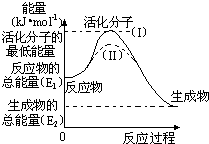
 在化学反应中,能引发化学反应的分子间碰撞称之为有效碰撞,这些分子称为活化分子.使普通分子变成活化分子所需提供的最低能量叫活化能,其单位用kJ?mol-1表示.请认真观察图,然后回答问题.
在化学反应中,能引发化学反应的分子间碰撞称之为有效碰撞,这些分子称为活化分子.使普通分子变成活化分子所需提供的最低能量叫活化能,其单位用kJ?mol-1表示.请认真观察图,然后回答问题.(1)图中反应是
放热
放热
(填“吸热”或“放热”)反应.(2)对于同一反应,图中虚线( II)与实线( I)相比,改变的条件是
催化剂
催化剂
,对反应热是否有影响?无/没影响
无/没影响
,原因是反应热只与反应物和生成物的始态有关/催化剂只改变活化能
反应热只与反应物和生成物的始态有关/催化剂只改变活化能
.(3)已知 C(s)+O2(g)=CO2(g);△H=-393.5kJ/mol
CO(g)+
| 1 |
| 2 |
请写出C(s)与O2(g)反应生成CO(g)的热化学方程式
C(s)+
O2(g)=CO(g)的△H=-110.5kJ/mol
| 1 |
| 2 |
C(s)+
O2(g)=CO(g)的△H=-110.5kJ/mol
.| 1 |
| 2 |
分析:(1)依据图象分析反应物的能量大于生成物的能量,反应放热;
(2)对于同一反应,图中虚线( II)与实线( I)相比,活化能大大降低,活化分子的百分数增多,反应速率加快,说明反应的活化能降低焓变不变,平衡不动,结合影响反应速率的因素分析判断;
(3)利用盖斯定律计算,将(1)-(2),可得 C(s)+
O2(g)=CO(g),反应热随之相加减,可求得反应热;
(2)对于同一反应,图中虚线( II)与实线( I)相比,活化能大大降低,活化分子的百分数增多,反应速率加快,说明反应的活化能降低焓变不变,平衡不动,结合影响反应速率的因素分析判断;
(3)利用盖斯定律计算,将(1)-(2),可得 C(s)+
| 1 |
| 2 |
解答:解:(1)依据图象分析反应物的能量大于生成物的能量,反应放热,故答案为:放热;
(2)对于同一反应,图中虚线( II)与实线( I)相比,活化能大大降低,活化分子的百分数增多,反应速率加快,说明反应的活化能降低焓变不变,平衡不动,化学反应速率影响因素中,催化剂有此作用,所以最有可能使用了催化剂,反应热不变,反应热只与反应物和生成物的始态有关,故答案为:催化剂; 无/没影响;反应热只与反应物和生成物的始态有关/催化剂只改变活化能;
(3)已知:(1)C(s)+O2(g)=CO2(g);△H=-393.5kJ/mol
(2)CO(g)+
O2(g)=CO2(g);△H=-283.0kJ/mol
利用盖斯定律,将(1)-(2),可得 C(s)+
O2(g)=CO(g),
则:△H=-393.5kJ/mol-(-283.0kJ/mol)=-110.5KJ/mol.
C(s)与O2(g)反应生成CO(g)的热化学方程式C(s)+
O2(g)=CO(g)的△H=-110.5 kJ/mol,故答案为:C(s)+
O2(g)=CO(g)的△H=-110.5 kJ/mol;
(2)对于同一反应,图中虚线( II)与实线( I)相比,活化能大大降低,活化分子的百分数增多,反应速率加快,说明反应的活化能降低焓变不变,平衡不动,化学反应速率影响因素中,催化剂有此作用,所以最有可能使用了催化剂,反应热不变,反应热只与反应物和生成物的始态有关,故答案为:催化剂; 无/没影响;反应热只与反应物和生成物的始态有关/催化剂只改变活化能;
(3)已知:(1)C(s)+O2(g)=CO2(g);△H=-393.5kJ/mol
(2)CO(g)+
| 1 |
| 2 |
利用盖斯定律,将(1)-(2),可得 C(s)+
| 1 |
| 2 |
则:△H=-393.5kJ/mol-(-283.0kJ/mol)=-110.5KJ/mol.
C(s)与O2(g)反应生成CO(g)的热化学方程式C(s)+
| 1 |
| 2 |
| 1 |
| 2 |
点评:本题考查了化学反应的能量变化与反应的焓变关系的分析判断,反应活化能的判断计算,图象的综合应用,读懂图象,盖斯定律的应用是解题关键.

练习册系列答案
 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案
相关题目