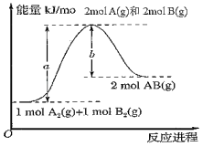
题目内容
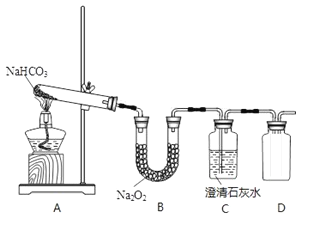
【题目】“封管试验”具有简易、方便、节约、绿色等优点。观察下列四个“封管试验”(夹持装置未画出),判断下列说法正确的是( )
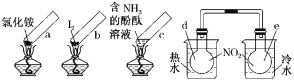
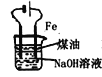
A.加热时,a上部聚集了固体NH4Cl,说明NH4Cl的热稳定性比较好
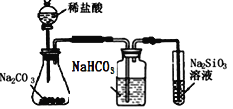
B.加热时,发现b中I2变为紫色蒸气,在上部又聚集为紫黑色的固体
C.加热时,c中溶液红色变深,冷却后又变浅
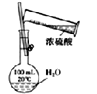
D.水浴时,d内气体颜色变浅,e内气体颜色加深
【答案】B
【解析】
A.加热时氯化铵分解生成氨气和氯化氢,在试管的顶部氨气和氯化氢又反应生成氯化铵,NH4Cl的热稳定性较差,故A错误;
B.加热碘升华变为紫色蒸气,在上部冷却聚集为紫黑色的碘固体,故B正确;
C.氨水显碱性使酚酞变红,加热时氨气逸出,溶液红色变浅,冷却后氨气又溶于水和水反应,溶液红色又变深,故C错误;
D.存在平衡:2NO2(g)![]() N2O4(g)△H= - 92.4kJ/ mol,正反应为放热反应,d浸泡在热水中,升高温度平衡向逆反应方向移动,二氧化氮浓度增大,d容器内气体颜色变深;e浸泡在冷水中,温度降低平衡向正反应移动,二氧化氮浓度降低,e容器内气体颜色变浅,故D错误;
N2O4(g)△H= - 92.4kJ/ mol,正反应为放热反应,d浸泡在热水中,升高温度平衡向逆反应方向移动,二氧化氮浓度增大,d容器内气体颜色变深;e浸泡在冷水中,温度降低平衡向正反应移动,二氧化氮浓度降低,e容器内气体颜色变浅,故D错误;
故答案:B。

练习册系列答案
相关题目
【题目】将气体X通入溶液A(如下图,尾气吸收装置略)中,实验现象能够支持结论的是
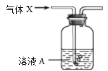
选项 | 气体X | 溶液A及反应现象 | 结论 |
A. | 乙醇与浓硫酸共热170℃产生的气体 | Br2的水溶液由橙黄色变为无色 | 乙烯与溴发生反应 |
B. | 电石与饱和食盐水反应产生的气体 | KMnO4酸性溶液紫色逐渐变浅 | 乙炔被高锰酸钾酸性溶液氧化 |
C. | 溴乙烷与氢氧化钠醇溶液共热生成的气体 | Br2的水溶液由橙黄色变为无色 | 乙烯与溴发生反应 |
D. | 碳酸钠固体与醋酸溶液反应产生的气体 | 苯酚钠溶液中出现白色沉淀 | 碳酸的酸性强于苯酚 |
A. A B. B C. C D. D