题目内容
短周期元素X、Y、Z、W的原子序数依次增大,其中Y、Z原子的核外电子数之和与X、W原子的核外电子数之和相等,Z单质可以用来冶炼其它熔点较高的金属,X和W间可形成一种能产生酸雨的化合物,则下列说法不正确的是
| A.原子半径从大到小顺序为:W>Z>Y>X |
| B.X与Y可形成既含离子键又含非极性共价键的化合物 |
| C.X、W分别形成简单的氢化物中,前者的沸点高 |
| D.X形成单核阴离子的核外电子数与Y、Z、W原子的核外内层电子数相同 |
A
解析试题分析:在短周期元素中,Z单质可以用来冶炼其它熔点较高的金属 ,则Z为Al元素。X和W间可形成一种能产生酸雨的化合物,则X为O元素,W为S元素,Y、Z原子的核外电子数之和与X、W原子的核外电子数之和相等。那么Y为Na元素。A. 同周期的元素,原子序数越大,原子半径越小;不同周期的元素,元素的原子核外电子层数越多,原子半径越大,所以这四种元素的原子半径由大到小的顺序为Na>Al>S>O 。错误。B.Na与O形成的化合物Na2O2中既含有离子键也含有非极性共价键。正确。C.O、S是同主族的元素,它们形成的氢化物都属于分子晶体。由于在水的分子之间存在氢键,增加了分子之间的相互作用,所以沸点H2O>H2S 。正确。
考点:考查元素的推断及元素与化合物的结构与性质的知识。

下列叙述正确的是
| A.同一周期元素的原子,半径越小越容易失去电子 |
| B.周期表中所有元素都是从自然界中发现的,过渡元素都是金属元素 |
| C.非金属元素形成的共价化合物中,原子的最外层都达到8电子稳定结构 |
| D.IA族与VIIA族元素间可形成共价化合物或离子化合物 |
对于Na+、Mg2+、Al3+三种离子,下列说法不正确的是( )
| A.核外电子层数相同 |
| B.半径大小顺序Na+<Mg2+<Al3+ |
| C.核外电子数相同 |
| D.最外层电子数相同 |
X、Y、Z、W是短周期的元素,原子序数依次递增。X与Z位于同一主族,Y元素的单质既能与盐酸反应也能与NaOH溶液反应,Z原子的最外层电子数是次外层电子数的一半,Y、Z、W原子的最外层电子数之和为14。下列说法正确的是( )
| A.原子半径由小到大的顺序为X<Y<Z<W |
| B.Z的最高价氧化物能与水反应生成相应的酸 |
| C.X、Z、W最高价氧化物对应水化物酸性的强弱顺序为Z<X<W |
| D.室温下,0.1 mol/L W的气态氢化物的水溶液的pH>1 |
Q、W、X、Y、Z是原子序数依次增大的短周期元素,X的焰色反应呈黄色。Q元素的原子最外层电子数是其内层电子数的2倍。W、Z最外层电子数相同,Z的核电荷数是W的2倍。元素Y的合金是日常生活中使用最广泛的金属材料之一。下列说法正确的是( )
| A.原子半径的大小顺序:rX>rY>rW>rQ |
| B.X、Y的最高价氧化物的水化物之间不能反应 |
| C.Z、W最外层电子数都为6,最高化合价都为+6价 |
| D.元素Q和Z能形成QZ2型的共价化合物 |
能说明元素X的原子得电子能力强于元素Y的原子的事实是( )
| A.元素周期表中元素X位于元素Y的上一个周期 |
| B.元素X的含氧酸的酸性强于元素Y的含氧酸 |
| C.分别加热H2X、HY至500 ℃,只有HY发生分解 |
| D.元素X与Y同主族,相同温度时其单质与铜反应分别生成Cu2X和CuY |
J、M、R、T是原子序数依次增大的短周期主族元素,J、R在周期表中的相对位置如表。已知J元素最低负化合价的绝对值与其原子最外层电子数相等,M是地壳中含量最多的金属元素。下列说法错误的是( )
| J | | |
| | | R |
B.工业上用电解熔融的M的氧化物方法来制备M
C.R、T两元素的气态氢化物中,T的气态氢化物更稳定
D.J、M、R、T元素最高价氧化物对应的水化物中酸性最强的是HTO4
X、Y、Z、W是分别位于第2、3周期的元素,原子序数依次递增。X与Z位于同一主族,Y元素的单质既能与盐酸反应也能与NaOH溶液反应,Z原子最外层电子数是次外层电子数的一半,Y、Z、W原子的最外层电子数之和为14。下列说法正确的是( )
| A.原子半径由小到大的顺序:X<Y<Z<W |
| B.Y单质在一定条件下可以与氧化铁发生置换反应 |
C.室温下,0.1 mol·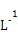 W的气态氢化物的水溶液的pH>1 W的气态氢化物的水溶液的pH>1 |
| D.Z的最高价氧化物能与水反应生成相应的酸 |
如图为元素周期表短周期的一部分。E原子的电子层数为n,最外层电子数为2n+1。下列叙述不正确的是( )
| A | | B | C |
| | | D | E |
B.A与B形成的阴离子可能有A
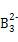 、A2
、A2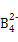
C.AD2分子中每个原子的最外层均为8电子结构
D.A、D、E的最高价氧化物对应的水化物的酸性依次增强