题目内容
X、Y、Z、W是分别位于第2、3周期的元素,原子序数依次递增。X与Z位于同一主族,Y元素的单质既能与盐酸反应也能与NaOH溶液反应,Z原子最外层电子数是次外层电子数的一半,Y、Z、W原子的最外层电子数之和为14。下列说法正确的是( )
| A.原子半径由小到大的顺序:X<Y<Z<W |
| B.Y单质在一定条件下可以与氧化铁发生置换反应 |
C.室温下,0.1 mol·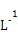 W的气态氢化物的水溶液的pH>1 W的气态氢化物的水溶液的pH>1 |
| D.Z的最高价氧化物能与水反应生成相应的酸 |
B
解析

练习册系列答案
相关题目
短周期元素X、Y、Z、W的原子序数依次增大,其中Y、Z原子的核外电子数之和与X、W原子的核外电子数之和相等,Z单质可以用来冶炼其它熔点较高的金属,X和W间可形成一种能产生酸雨的化合物,则下列说法不正确的是
| A.原子半径从大到小顺序为:W>Z>Y>X |
| B.X与Y可形成既含离子键又含非极性共价键的化合物 |
| C.X、W分别形成简单的氢化物中,前者的沸点高 |
| D.X形成单核阴离子的核外电子数与Y、Z、W原子的核外内层电子数相同 |
短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中Z为地壳中含量最高的金属元素。下列说法正确的是
| | | | | | | X |
| Y | | Z | | | | W |
A.工业上电解ZW3饱和溶液冶炼金属Z
B.元素X的最高正价与W的最高正价相同
C.简单离子半径的大小顺序:r(Y+)>r(X—)
D.Y、W的最高价氧化物的水化物均能溶解金属Z
已知某离子的结构示意图为 ,下列说法正确的是( )
,下列说法正确的是( )
| A.该元素位于第二周期第ⅡA族 |
| B.该元素位于第二周期第Ⅷ族 |
| C.该元素位于第三周期第ⅡA族 |
| D.该元素位于第三周期0族 |
已知几种短周期元素的原子半径、常见的最高价和最低价如下表,下列说法中不正确的是 ( )
| 元素性质 | 元素编号 | ||||||
| ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | |
| 原子半径(nm) | 0.073 | 0.075 | 0.152 | 0.110 | 0.099 | 0.186 | 0.143 |
| 最高正化合价 | 无 | +5 | +1 | +5 | +7 | +1 | +3 |
| 最低负化合价 | -2 | -3 | 无 | -3 | -1 | 无 | 无 |
A.⑦的简单离子不是同周期元素离子半径最小的
B.气态氢化物的稳定性①>②
C.②的气态氢化物浓溶液可用于检验氯气管道的泄漏
D.阴离子的还原性④大于⑤,最高价氧化物的水化物的碱性③小于⑥
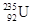 是重要的核工业原料,但在自然界的丰度很低,
是重要的核工业原料,但在自然界的丰度很低,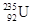 的浓缩一直为国际社会关注。下列有关
的浓缩一直为国际社会关注。下列有关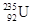 说法正确的是( )
说法正确的是( )
A.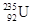 原子核中含有92个中子 原子核中含有92个中子 | B.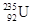 原子核外有143个电子 原子核外有143个电子 |
C.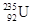 与 与 是同一种核素 是同一种核素 | D.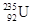 与 与 互为同位素 互为同位素 |
在周期表主族元素中,甲元素与乙、丙、丁三元素紧密相邻(上下或左右),甲、乙两元素的原子序数之和等于丙元素的原子序数,这四种元素原子的最外层电子数之和为20。下列说法正确的是( )
| A.甲、乙、丙、丁四种元素均为短周期元素 |
| B.气态氢化物的稳定性:甲>乙 |
| C.最高价氧化物对应的水化物的酸性:甲<丙 |
| D.元素丁与乙形成的化合物中可能含有离子键 |
正长石的主要成分为硅酸盐,由前20号元素中的4种组成,化学式为XYZ3W8。其中,只有W显负价。X、Y的最外层电子数之和与Z的最高正价数相等。Y3+与W的阴离子具有相同的电子层结构。X、W的质子数之和等于Y、Z的质子数之和。下列说法错误的是( )
| A.X的离子半径>Y的离子半径 |
| B.Z的氢化物的稳定性<W的氢化物的稳定性 |
| C.Y的氧化物既能与盐酸反应,又能与NaOH溶液反应 |
| D.X2W2、Y2W3两种化合物含有的化学键类型完全相同 |
下图是部分短周期元素原子半径与原子序数的关系图,下列说法不正确的是( )
| A.N、Z两种元素的离子半径相比前者较大 |
| B.M、N两种元素的气态氢化物的稳定性相比后者较强 |
| C.X与M两种元素组成的化合物能与碱反应,但不能与任何酸反应 |
| D.工业上常用电解Y和N形成的化合物的熔融态制取Y的单质 |