题目内容
9.(1)按已知的原子结构规律,82号元素X应是第6周期ⅣA族元素,它的最高正价氧化物的化学式为XO2或PbO2.(2)以下反应:①木炭与水制备水煤气 ②氯酸钾分解 ③炸药爆炸 ④酸与碱的中和反应 ⑤生石灰与水作用制熟石灰 ⑥Ba(OH)2•8H2O与NH4Cl,属于放热反应③④⑤填序号),写出反应⑥的化学方程式Ba(OH)2•8H2O+2NH4Cl=BaCl2+2NH3↑+10H2O.
(3)在下列化合物中:H2O2、Na2O、I2、NaCl、CO2、NH4Cl、Na2O2,用化学式回答下列问题:
①只由非金属组成的离子化合物是NH4Cl,
②只有极性共价键的共价化合物是CO2,
③只含有非极性共价键的是I2,
④既有离子键又有非极性键的化合物是Na2O2.
分析 (1)根据电子排布规律写出该原子原子结构示意图,根据电子层数判断周期数,根据价电子判断所属族数,根据价电子判断其最高价氧化物化学式;
(2)大多数的化合反应、所有燃烧反应、酸碱中和反应、金属与酸的反应等,属于放热反应,硫酸、氢氧化钠等溶解为放热过程;大多数的分解反应、以CO或碳或氢气为还原剂的反应、氢氧化钡与氯化铵的反应等,属于吸热反应,一些铵盐的溶解为吸热过程;
Ba(OH)2•8H2O与NH4Cl反应生成氯化钡、氨气与水;
(3)一般来说,活泼金属和活泼非金属元素之间易形成离子键,非金属元素之间易形成共价键,含有离子键的化合物是离子化合物,只含共价键的化合物是共价化合物,以此解答.
解答 解:(1)该原子的原子结构示意图为 ,电子层数=周期数=6,最外层电子数=族序数=4,主族元素的最高化合价数=其最外层电子数=4,所以其最高价氧化物的化学式为:XO2或PbO2,
,电子层数=周期数=6,最外层电子数=族序数=4,主族元素的最高化合价数=其最外层电子数=4,所以其最高价氧化物的化学式为:XO2或PbO2,
故答案为:6;ⅣA;XO2或PbO2;
(2)①木炭与水制备水煤气,属于吸热反应,②高锰酸钾的分解,属于吸热反应,③炸药爆炸,属于放热反应,④酸与碱的中和反应属于放热反应,⑤生石灰与水作用制熟石灰,属于放热反应,⑥Ba(OH)2•8H2O与NH4Cl,属于吸热反应,⑦硫酸溶解于水,属于放热过程,⑧硝酸铵溶解于水吸热过程,属于放热反应有③④⑤,反应⑥的化学方程式:Ba(OH)2•8H2O+2NH4Cl=BaCl2+2NH3↑+10H2O,
故答案为:③④⑤;Ba(OH)2•8H2O+2NH4Cl=BaCl2+2NH3↑+10H2O;
(3)①铵盐是全部由非金属元素组成的离子化合物,符合条件的是氯化铵,故答案为:NH4Cl;
②只含共价键的化合物是共价化合物,不同非金属元素之间易形成极性共价键,只有极性键构成的共价化合物为CO2,故答案为:CO2;
③同种非金属元素之间形成非极性共价键,符合条件的是I2,故答案为:I2;
④活泼金属和活泼非金属元素之间易形成离子键,同种非金属元素之间易形成非极性共价键,则符合条件的是Na2O2,故答案为:Na2O2.
点评 本题考查位置结构性质关系、吸热反应与放热反应、化学键等,属于拼合型题目,需要学生熟练掌握基础知识,难度不大.

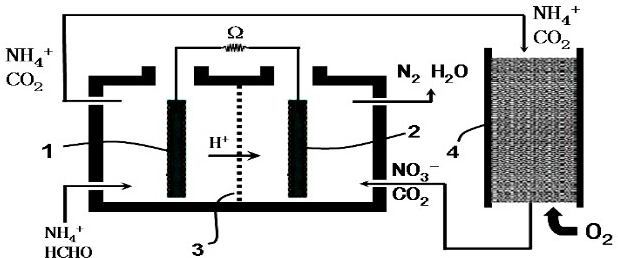
| A. | 负极发生的反应为:HCHO-4e-+H2O═CO2+4H+ | |
| B. | 负极所在的左室中需保持厌氧环境 | |
| C. | NH4+通过循环操作最终被转化成N2 | |
| D. | O2参与正极反应,发生还原反应 |
| A. | 由于甲酸的缘故,人被蜂蚁蜇咬后会感觉疼痛难忍,涂抹稀氨水或碳酸氢钠溶液,可以减轻疼痛 | |
| B. | 用浸过酸性高锰酸钾溶液的硅藻土吸收水果、花朵产生的乙烯,可以延长果实或花朵的成熟期 | |
| C. | 将金属与电源正极相连可有效保护金属不被腐蚀 | |
| D. | 泡沫灭火器利用双水解原理喷出泡沫覆盖在燃烧物品上,使燃着的物质与空气隔离,并降低温度,达到灭火的目的 |
| A. | 用热的纯碱清洗油污 | B. | 氯气难溶于NaCl溶液中 | ||
| C. | 明矾的净水作用 | D. | 泡沫灭火器的使用原理 |
| A. | CH3CH(Br)OH | B. | CH3CH(CH2OH)CHO | ||
| C. | CH3CH2CH(CH3)CH2CH3 | D. | HOOCCH(Br)COOCH3 |
| A. | 温室效应--CO2 | B. | 光化学污染--NO2 | C. | 酸雨--SO2 | D. | 臭氧层破坏--CO |
| A. | 原子半径:D>E>C>B>A | |
| B. | 热稳定性:EA4>A2C | |
| C. | 单质D可用海水作原料获得 | |
| D. | 化合物DC与化合物EC2中化学键类型相同 |
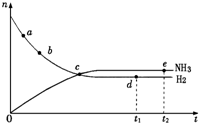 合成氨工业对国民经济和社会发展具有重要的意义,对于密闭 容器中的反应:N2(g)+3H2(g)?2NH3(g)(正反应为放热反应),673K、30MPa下n(NH3)和n(H2)随时间变化的关系如图所示.下列叙述正确的是( )
合成氨工业对国民经济和社会发展具有重要的意义,对于密闭 容器中的反应:N2(g)+3H2(g)?2NH3(g)(正反应为放热反应),673K、30MPa下n(NH3)和n(H2)随时间变化的关系如图所示.下列叙述正确的是( )| A. | 点a的正反应速率比点b的大 | |
| B. | 点c处反应达到平衡 | |
| C. | 点d (t1时刻)和点e (t2时刻)处n (N2)不一样 | |
| D. | 其他条件不变,773K下反应至t1时刻,n(H2)比图中d点的值大 |