题目内容
【题目】下列实验操作规范且能达到实验目的的是( )
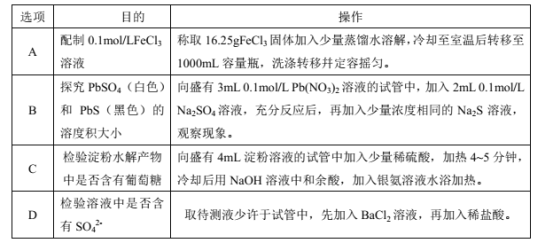
A.AB.BC.CD.D
【答案】C
【解析】
A.氯化铁在水溶液中由于水解会呈酸性,生成氢氧化铁胶体,故FeCl3固体不能直接用蒸馏水溶解,故A错误;
B.Pb2+和SO42-反应生成PbSO4,但是Pb2+的量过量,加入Na2S时,若有黑色沉淀PbS生成,不能说明PbSO4转化为PbS,不能说明Ksp(PbSO4)>Ksp(PbS),故B错误;
C.淀粉水解生成葡萄糖,在碱性溶液中葡萄糖可发生银镜反应,则冷却至室温,再加入氢氧化钠中和至碱性。加入银氨溶液水浴加热,产生银镜。说明淀粉水解能产生还原性糖,故C正确;
D.硫酸根离子检验用盐酸酸化的氯化钡溶液,所以应该先加入稀盐酸,没有沉淀后再加入氯化钡溶液,如果有白色沉淀就说明有硫酸根离子,否则不含硫酸根离子,故D错误;
答案选C。

 阅读快车系列答案
阅读快车系列答案【题目】下表为元素周期表的短周期部分
a | |||||||
b | c | d | |||||
e | f | g | h |
请参照元素a﹣h在表中的位置,根据判断出的元素回答问题:
(1)h原子核外有______ 种不同伸展方向的电子云,最外层共有______ 种不同运动状态的电子。
(2)比较d、e元素常见离子的半径大小(用化学式表示)______>______;b、c 两元素非金属性较强的是(写元素符号)______,写出证明这一结论的一个化学方程式______。
(3)d、e元素形成的四原子化合物的电子式为______;b、g元素形成的分子bg2为______分子(填写“极性”或“非极性”)。
(4)上述元素可组成盐R:ca4f(gd4)2,和盐S:ca4agd4,相同条件下,0.1mol/L 盐R中c(ca4+)______(填“等于”、“大于”或“小于”)0.1mol/L 盐S中c(ca4+)
(5)向盛有10mL1mol/L盐S溶液的烧杯中滴加1mol/L NaOH溶液至中性,则反应后各离子浓度由大到小的排列顺序是______。
(6)向盛有10mL 1mol/L盐 R溶液的烧杯中滴加1mol/L NaOH溶液32mL后,继续滴加至35mL写出此时段(32mL﹣35mL)间发生的离子方程式:______。若在10mL 1mol/L 盐R溶液的烧杯中加20mL1.2mol/L Ba(OH)2溶液,充分反应后,溶液中产生沉淀的物质的量为______mol。
【题目】烷烃是由碳元素和氢元素组成的一类有机物,通常把烷烃泛称“某烷”,“某”是指烷烃中碳原子的数目.碳原子数在十以内的烷烃,依次用“天干”(甲乙丙丁戊己庚辛壬癸)来代表其碳原子数.部分有机物分子组成和结构的表示方法如下:
名称 | 甲烷 | 乙烷 | 丙烷 | 丁烷 | 戊烷 |
化学式 | CH4 | C2H6 | C3H8 | C4H10 | C5H12 |
结构式 |
|
|
|
|
|
据此推测己烷的化学式为( )
A.C6H12B.C6H24C.C6H18D.C6H14