题目内容
【题目】如图是元素周期表的一部分:
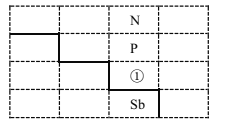
(1)写出元素①的元素符号________,与①同周期的主族元素中,第一电离能比①大的有_______种。
(2)基态锑(Sb)原子的价电子排布式为_______。[H2F]+[SbF6]-(氟酸锑)是一种超强酸,则[H2F]+离子的空间构型为______,写出一种与[H2F]+互为等电子体的分子 ____ 。
(3)下列说法正确的是________
a.N2H4分子中含5个σ键和1个π键
b.基态P原子中,电子占据的最高能级符号为M
c.Sb 位于p区
d.升温实现―液氨→氨气→氮气和氢气变化的阶段中,微粒间破坏的主要的作用力依次是氢键、极性 共价键。
(4)GaN、GaP都是很好的半导体材料,晶体类型与晶体硅类似,熔点如下表所示,解释GaN、GaP熔点变化原因________。

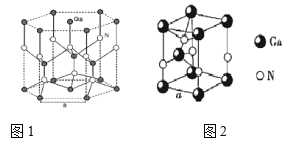
(5)GaN晶胞结构如图1所示,已知六棱柱底边边长为a cm。
①晶胞中Ga原子采用六方最密堆积方式,每个Ga原子周围距离最近的Ga原子数目为________;
②从GaN 晶体中分割出的平行六面体如图 。若该平行六面体的体积为![]() a3cm3,GaN 晶体的密度为______g/cm3 (用a、NA 表示)。
a3cm3,GaN 晶体的密度为______g/cm3 (用a、NA 表示)。
【答案】As 1 5s25p3 V形 H2O c,d 两者属于原子晶体,半径N<P,键长Ga-N<Ga-P,键能Ga-N>Ga-P,故熔点前者高 12 ![]()
【解析】
(1)根据氮族元素的名称回答,根据电离能递变规律回答;
(2)根据核外电子排布式,写出价电子排布式;利用价层电子对互斥理论分析;
离子的立体构型;根据价电子数和原子数相同的分子寻找合适的等电子体;
(3)a.N2H4分子的结构为![]() .确定化学键的类型;
.确定化学键的类型;
b.基态P原子中,核外电子排布为1s22s22p63s23p3,确定最高能层和能级;
c.根据元素周期表的分区确定Sb 位于p区;
d.升温实现―液氨→氨气→氮气和氢气变化的阶段中,升温实现―液氨→氨气,微粒间破坏的主要的作用力是氢键,氨气→氮气和氢气破坏的是极性共价键;
(4)它们都是原子晶体,从原子半径联系到化学键的强弱,原子晶体的熔点主要受化学键强度的影响;
(5)Ga原子采用六方最密堆积方式,从图中可以看出上底面中心的Ga原子距离最近的Ga原子;
(6)根据密度公式![]() =
=![]() 进行计算;
进行计算;
(1)根据表格可知①的元素符号As,第四周期的主族元素,第一电离能逐渐呈现增大的趋势,由于As原子的最外层电子处于半充满状态,比后面的Se的第一电离能高,只有Br的第一电离能比As高,故只有Br元素的第一电离能比它高;
(2)Sb的价电子排布式为5s25p3,[H2F]+的中心原子为F,它的最外层电子数为7,它的孤电子对数为![]() ×(7-1-1×2)=2,成键电子对数为2,价层电子对数=2+2=4,VSEPR模型为四面体,由于有两对孤对电子,故分子的立体构型为V形,与[H2F]+互为等电子体的分子应该有10个电子,3个原子,为H2O;
×(7-1-1×2)=2,成键电子对数为2,价层电子对数=2+2=4,VSEPR模型为四面体,由于有两对孤对电子,故分子的立体构型为V形,与[H2F]+互为等电子体的分子应该有10个电子,3个原子,为H2O;
(3)a.N2H4分子的结构为![]() ,有4个N-Hσ键,一个N-Nσ键,故a错误;
,有4个N-Hσ键,一个N-Nσ键,故a错误;
b.基态P原子中,核外电子排布为1s22s22p63s23p3,确定最高能级为3p,最高能层为M,故b错误;
c.Sb的最后排入的电子的能级为5p,根据元素周期表的分区确定Sb 位于p区,故c正确;
d.升温实现―液氨→氨气→氮气和氢气变化的阶段中,升温实现―液氨→氨气,由液态变成气态,微粒间破坏的主要的作用力是氢键,氨气→氮气和氢气破坏的是极性共价键,故d正确;
(4)GaN、GaP都是很好的半导体材料,晶体类型与晶体硅类似,都属于原子晶体,两者属于原子晶体,原子半径N<P,键长Ga-N<Ga-P,键能Ga-N>Ga-P,故熔点前者高;
(5)Ga原子采用六方最密堆积方式,从图中可以看出上底面中心的Ga原子距离最近的Ga原子;数目为6个,体心下方有3个Ga原子,体心上方有3个Ga原子,共12个;
(6)Ga原子数为8×![]() +1=2,N原子数为4×
+1=2,N原子数为4×![]() +1=2,V=
+1=2,V=![]() a3cm3根据密度公式=
a3cm3根据密度公式=![]() =
=![]() =
=![]() 。
。

 53天天练系列答案
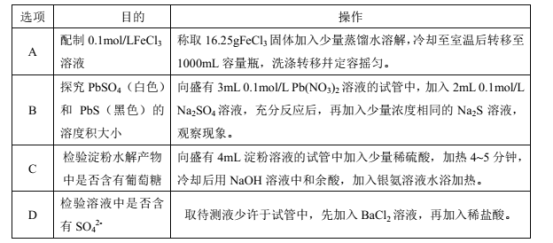
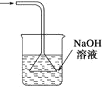
53天天练系列答案【题目】实验室里运用下列实验装置进行实验,能达到相应实验目的并符合环保的是( )
A | B | C | D |
|
|
|
|
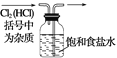
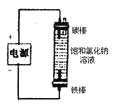
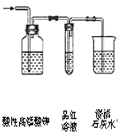
除去氯气中的杂质 | 制取84消毒液(NaClO) | 检验二氧化硫中是否混有二氧化碳 | 吸收氯化氢尾气 |
A.AB.BC.CD.D