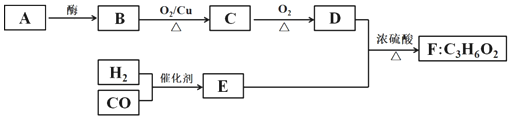
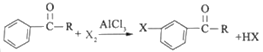题目内容
【题目】一种新兴材料——铍日益被重视,有“超级金属…尖端金属…空间金属”之称。工业上常用绿柱石(主要成分3 BeO·Al2O3·6SiO2,还含有铁等杂质)冶炼铍,一种简化的工艺流程如下:
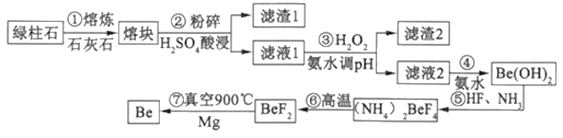
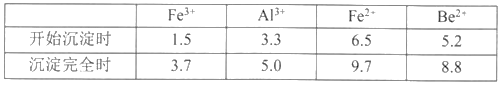
按元素周期表的对角线规则,Be和Al性质相似:几种金属阳离子的氢氧化物沉淀时的pH如表。回答下列问题:
(1)步骤②中将熔块粉碎的目的是___________;滤渣1的主要成分是___________。
(2)步骤③加入H2O2时发生反应的离子方程式为___________,从滤液1中得到沉淀的合理pH为___________(填序号)
A.3.3—3.7 B.3.7—5.0 C.5.0—5.2 D.5.2—6.5
(3)步骤④不宜使用NaOH溶液来沉淀Be2+的原因是___________。从溶液中得到(NH4)2BeF4的实验操作是___________、过滤、洗涤、干燥。
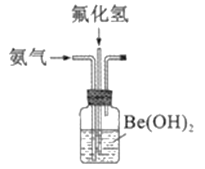
(4)实验室模拟步骤⑤装置如图,控制氨气与氟化氢气体积比的方法是_______________。
(5)步骤⑥的反应类型是___________,步骤⑦需要隔绝空气的环境,其原因是___________。
(6)若绿柱石中BeO的含量为a%,上述过程生产Be的产率为b%,则1t该绿柱石理论上能生产含铍量2%的镀铜合金___________t。
【答案】增大与硫酸的接触面积,提高浸取率和反应速率 H2SiO3 2H++H2O2+2Fe2+=2Fe3++2H2O C 过量NaOH溶液会溶解Be(OH)2 蒸发浓缩、冷却结晶 通过观察广口瓶中产生气泡的速率调节流速 分解反应 高温下,Mg(或铍)与N2、O2等气体发生反应,降低产率 1.8×10-3ab
【解析】
(1)将熔块粉碎的目的是增大与硫酸的接触面积,提高浸取率和反应速率;根据绿柱石的成分,熔炼过程中SiO2与石灰石生成CaSiO3,CaSiO3与硫酸反应生成CaSO4和H2SiO3,即滤渣1的主要成分为H2SiO3;
(2)根据流程,滤液1中含有阳离子是Fe2+、Al3+、Be2+、H+,步骤③中加入H2O2,H2O2把Fe2+氧化成Fe3+,即离子方程式为2H++H2O2+2Fe2+=2Fe3++2H2O;根据流程,步骤③除去的是Fe3+、Al3+,加入氨水调节pH,使Fe3+、Al3+以Al(OH)3、Fe(OH)3形式除去,因此调节pH范围是5.0≤pH<5.2,故选项C正确;
(3)因为Be和Al的性质相似,即Be(OH)2为两性氢氧化物,过量NaOH溶液会溶解Be(OH)2;从溶液中得到(NH4)2BeF4的实验操作是蒸发浓缩、冷却结晶、过滤、洗涤、干燥;
(4)根据装置,通过观察广口瓶中产生气泡的速率调节流速;
(5)步骤⑥的反应类型为分解反应;Be和Al的性质相似,Mg是活泼金属,能与空气中氧气发生反应,因此隔绝空气的环境的原因是高温下,Mg(或铍)与N2、O2等气体发生反应,降低产率;
(6)根据题意得出:![]() =m(合金)×2%,得出m(合金)=1.8×10-3abt。
=m(合金)×2%,得出m(合金)=1.8×10-3abt。

 阳光课堂课时优化作业系列答案
阳光课堂课时优化作业系列答案