题目内容
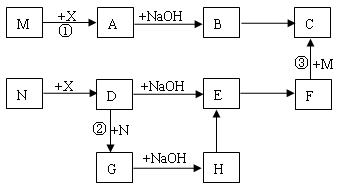
(13分)已知有以下物质相互转化,其中A为单质
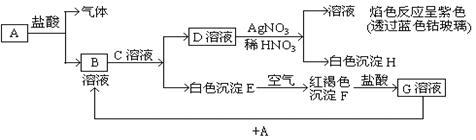
试回答:
(1)写出下列物质的化学式:
A ;B ; H ;F
;B ; H ;F
(2)写出由A转变成B的离子反应方程式
(3)写出用KSCN溶液鉴别G溶液的离子方程式
(4)写出G溶液加入A的有关离子反应方程式

试回答:
(1)写出下列物质的化学式:
A
 ;B ; H ;F
;B ; H ;F (2)写出由A转变成B的离子反应方程式

(3)写出用KSCN溶液鉴别G溶液的离子方程式
(4)写出G溶液加入A的有关离子反应方程式
(13 分)(1) Fe FeCl2 AgCl Fe(OH)3(各1分共4分)
(2)Fe+ 2H+=Fe2+ + H2↑
(3)Fe3++3SCN-=Fe(SCN)3
(4)2Fe3++Fe=3Fe2+ (方程式各3分,)
(2)Fe+ 2H+=Fe2+ + H2↑
(3)Fe3++3SCN-=Fe(SCN)3
(4)2Fe3++Fe=3Fe2+ (方程式各3分,)
略

练习册系列答案
 期末集结号系列答案
期末集结号系列答案
相关题目
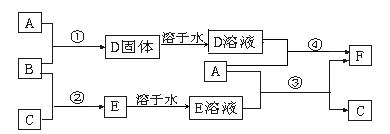
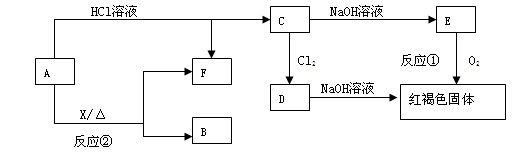
 某化学兴趣小组用含A、B两种金属单质的粉末状混合物进行如下实验,其转化关系如图所示(部分反应物或生成物未列出),其中E为白色沉淀,I为红褐色沉淀。
某化学兴趣小组用含A、B两种金属单质的粉末状混合物进行如下实验,其转化关系如图所示(部分反应物或生成物未列出),其中E为白色沉淀,I为红褐色沉淀。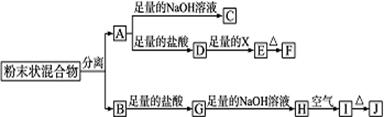

 )设计检验G溶液中阳离子的方法。
)设计检验G溶液中阳离子的方法。  。
。
 2)画出X的组成元素原子结构简图 ▲ 。
2)画出X的组成元素原子结构简图 ▲ 。 2CA3(g)
2CA3(g) .0 L.
.0 L.