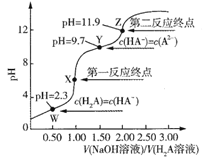
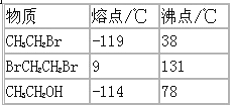
题目内容
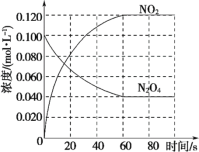
【题目】工业上电化学法生产硫酸的工艺示意图如图,电池以固体金属氧化物作电解质,该电解质能传导O2-离子,已知S(g)在负极发生的反应为可逆反应,则下列说法正确的是( )
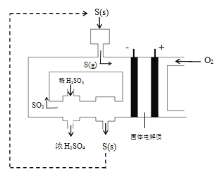
A.在负极S(g)只发生反应S-6e-+3O2-=SO3
B.该工艺用稀硫酸吸收SO3可提高S(g)的转化率
C.每生产1L浓度为98%,密度为1.84g/mL的浓硫酸,理论上将消耗30mol氧气
D.工艺中稀硫酸浓度增大的原因是水参与电极放电质量减少
【答案】B
【解析】
A.据图可知反应过程中有SO2生成,所以负极还发生S-4e-+2O2-=SO2,故A错误;
B.S(g)在负极发生的反应为可逆反应,吸收生成物SO3可使反应正向移动,提高S的转化率,故B正确;
C.浓度为98%,密度为1.84g/mL的浓硫酸中n(H2SO4)=![]() =18.4mol,由S~6e-~1.5O2~H2SO4可知,消耗氧气为18.4mol×1.5=27.6mol,故C错误;
=18.4mol,由S~6e-~1.5O2~H2SO4可知,消耗氧气为18.4mol×1.5=27.6mol,故C错误;
D.工艺中稀硫酸浓度增大的原因是负极生成的三氧化硫与水反应生成硫酸,故D错误;
故答案为B。

 同步轻松练习系列答案
同步轻松练习系列答案 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案【题目】中国是稀土资源大国,稀土是化学元素周期表中镧系元素和钪、钇共十七种金属元素的总称,被誉为“万能之土”。某小组以钇矿石(Y2FeBe2Si2O10)为主要原料制备氧化钇(Y2O3)和铍的流程(部分条件和产物省略)如图所示:
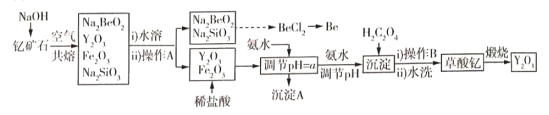
已知部分信息如下:
①铍、铝的单质及其化合物的化学性质相似;
②稀土元素都是活泼金属,性质相似,常见化合价为+3;
③Fe3+ Y3+形成的氢氧化物沉淀的pH范围如表所示:
离子 | Fe3+ | Y3+ |
开始沉淀的PH | 2.1 | 6.0 |
完全沉淀的PH | 3.1 | 8.3 |
请回答下列问题:
(1)沉淀A的主要成分是______(填化学式);操作A的名称是____________________。
(2)钇矿石与氢氧化钠共熔反应中的氧化产物为__________;写出加入草酸生成沉淀的离子方程式:___________;草酸钇隔绝空气煅烧的方程式______________。
(3)调节pH=a,则a的范围为______________。
(4)已知常温下;K[Y(OH)3]=1.0×10-23。Y3++3H2O=Y(OH)3+3H+平衡常数为K,则pK=-lgK=_____。
(5)叙述由Na2SiO3和Na2BeO3溶液制取BeCl2固体的过程:_______________。