��Ŀ����
����Ŀ������أ�KIO3������Ҫ��ʳƷ���Ӽ���ij��ѧ��ȤС��������в�����ȡKIO3�������в�Ʒ�Ĵ��Ȳⶨ��
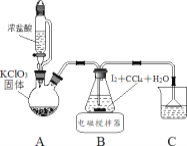
��ȡ���ᣨHIO3����ʵ��װ��ʾ��ͼ���й��������£�
HIO3 | �ٰ�ɫ���壬������ˮ�����������Ȼ�̼ ��Ka��0.169mol��L��1 |
KIO3 | �ٰ�ɫ���壬������ˮ���������Ҵ� �ڼ���������������Ӧ�� ClO��+ IO3- ��IO4 -+ Cl- |
�ش��������⣺
������� Cl2 ���� I2 ��ȡ HIO3
��1��װ�� A �з�����Ӧ�Ļ�ѧ����ʽ_______��
��2��װ�� B �е� CCl4 ���Լӿ췴Ӧ���ʣ�ԭ��_______��
��3����Ӧ������ȡ HIO3 ��Һ�IJ����У����貣���������ձ���________��_______��
������� KOH �к� HIO3 ��ȡ KIO3
��4�����кͷ�Ӧ�����ӷ���ʽΪ_______���к�֮ǰ��Ӧ������ HIO3��Һ������ӽ���ɫ�������к�ʱ������_______���ѧʽ�������� KIO3 �IJ�����
��5�����кͺ����Һ�м�������_______�������衢���á����˵Ȳ������õ���ɫ���塣
��6��Ϊ��֤���ȡ����������������ˮ���μ����� SO2 ������Һ��ҡ�ȣ��ټ��뼸�ε�����Һ����Һ��������ʵ��ʱ�����ӵ� SO2 ������Һ������������ɫ���֣�ԭ����_______��
����Ȳⶨ
��7��ȡ 0.1000 g ��Ʒ�ڵ���ƿ�У�����ϡ��������� KI ��Һ���� 0.1000 mol��L��1Na2S2O3��Һ�ζ����ӽ��յ�ʱ���������ָʾ���������ζ����յ㣬��ɫ��ʧ��I2+2S2O32-��2I-+S4O62-��������ƽ��ʵ���ƽ������ Na2S2O3 ��Һ�����Ϊ 24.00 mL�����Ʒ�� KIO3 ����������Ϊ_______��[M��KIO3����214.0 g��mol-1]
���𰸡�KClO3+6HCl(Ũ)=KCl+3Cl2��+3H2O I2��Cl2������CCl4�������˷�Ӧ��Ũ�� ��Һ©�� ������ HIO3+OH=IO3+H2O ClO �Ҵ�(�����ƾ�����C2H5OH��) ������SO2�ܽ�IO3-��I2�Ȼ�ԭΪI 85.60%
��������
��������Cl2����I2��ȡHIO3��Aװ���Ʊ�������Bװ��Cl2����I2��ȡHIO3��Cװ������β������������KOH�к�HIO3��ȡKIO3��1����ʵ��ԭ����װ��ͼ��֪��װ��A������غ�Ũ������ȡ������ͬʱ����KCl��ˮ���ݴ���д����2������Cl2��I2��ˮ���ܽ��С����CCl4���ܽ��ȴ�ܴ�������Ӧ��Ũ�ȣ��ݴ˿ɵã���3������������Ϣ��֪��B�з�Ӧ������ĵ�����Ҫ��ˮ��Һ������CCl4�������ܣ����Ա�����÷�Һ���Ի�ȡ������Һ��
��4��KOH��HIO3�����кͷ�Ӧ����KIO3��ˮ���ݴ���д���к�֮ǰ��Һ�д��ڽ϶�Cl2���к�ʱCl2ת��ΪClO-��������֪������������������Ӧ��ClO-+IO3-=IO4-+Cl-����������5������KIO3�������Ҵ���������6��SO2���л�ԭ�ԣ�������SO2��IO3-��I2�Ȼ�ԭΪI-����7��ȡ0.1000 g��Ʒ�ڵ���ƿ�У�����ϡ���������KI��Һ��������Ӧ��IO3-+5I-+6H+=3I2+3H2O����0.1000 molL-1Na2S2O3��Һ�ζ����ɵ�I2������KIO3��3I2��6S2O32-��ϵʽ���ɼ�������
��1��װ��A������ȡ��������ӦΪ��KClO3+6HCl(Ũ)=KCl+3Cl2��+3H2O���ʴ�Ϊ��KClO3+6HCl(Ũ)=KCl+3Cl2��+3H2O��
��2������Cl2��I2��ˮ���ܽ��С����CCl4���ܽ��ȴ�ܴ�װ��B�е�CCl4������Ӧ��Ũ�ȣ�ʹ��Ӧ���ʼӿ죬�ʴ�Ϊ��I2��Cl2������CCl4�������˷�Ӧ��Ũ�ȣ�
��3������������Ϣ��֪��B�з�Ӧ������ĵ�����Ҫ��ˮ��Һ������CCl4�������ܣ����Ա�����÷�Һ���Ի�ȡ������Һ����Һ��Ҫ�IJ����������ձ�����Һ©�������������ʴ�Ϊ����Һ©������������
��4��KOH��HIO3�����кͷ�Ӧ����KIO3��ˮ��HIO3����������ʣ������ӷ���ʽ�б�����ѧʽ�������ӷ���ʽΪ��HIO3+OH=IO3+H2O���к�֮ǰ��Һ�д��ڽ϶�Cl2��ͨ��������п��Գ�ȥCl2�������к�ʱCl2ת��ΪClO��ClO-��һ����IO3����ΪIO4���Ӷ�����KIO3�����½����ʴ�Ϊ��HIO3+OH=IO3+H2O��ClO��
��5��KIO3�������Ҵ������������Ҵ�����ʹKIO3����Һ�������������кͺ����Һ�м��������Ҵ��������衢���á����˵Ȳ������õ���ɫ���壻�ʴ�Ϊ���Ҵ�(�����ƾ�����C2H5OH��)��
��6���������֪����������SO2ˮ��Һ�ܽ�KIO3��ԭΪI2���������������SO2ˮ��Һȴ����ɫ���֣�˵��������SO2�ܽ�IO3-��I2�Ȼ�ԭΪI���ʴ�Ϊ��������SO2�ܽ�IO3-��I2�Ȼ�ԭΪI��
��7��ȡ0.1000g��Ʒ�ڵ���ƿ�У�����ϡ���������KI��Һ��������Ӧ��IO3+5I+6H+=3I2+3H2O����0.1000 mol/LNa2S2O3��Һ�ζ����ɵ�I2���й�ϵʽ��KIO33I26S2O32����n(KIO3)=![]() n(Na2S2O3)=
n(Na2S2O3)=![]() ��0.1000mol/L��0.024L=0.0004mol��
��0.1000mol/L��0.024L=0.0004mol�� ![]() ��100%=85.60%���ʴ�Ϊ��85.60%��
��100%=85.60%���ʴ�Ϊ��85.60%��

 С��ʿ��ĩ����100��ϵ�д�
С��ʿ��ĩ����100��ϵ�д� ��У��ʦ������ҵ���Ӻ����Ծ�ϵ�д�
��У��ʦ������ҵ���Ӻ����Ծ�ϵ�д�����Ŀ������ʵ���������Ӧ���۾���ȷ���ǣ� ��
ѡ�� | |||
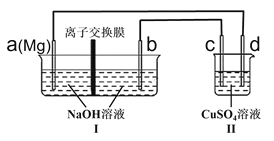
A | ��Fe(NO3)2��Һ�е��������ữ��H2O2��Һ | ��Һ��Ϊ��ɫ | �����ԣ�H2O2>Fe2+ |
B | ���������Һ�еμ����� | ��Һ����� | �ȵķǽ�����ǿ�ڹ裬�ʶ��������Ƶù��� |
C | ����ˮ�еμӱ������� | Һ����ֲַ㣬�ϲ�����ɫ���²㰴����ɫ | ��ͬ�¶��£����ڱ��е��ܽ��Զ��������ˮ�е��ܽ�ȡ� |
D | �������������ƹ���Ͷ����ɫʯ����Һ�� | ��Һ�����ɫ | ����������ˮ��Ӧ�����������ƣ���Һ�ʼ��� |
A.AB.BC.CD.D
����Ŀ������ʵ���о��к���ɫ����������Աȷ������ý��۲���ȷ���ǣ� ��
|
|
|
�� | �� | �� |
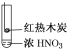
A.�ɢ��еĺ���ɫ���壬�ƶϲ���������һ���ǻ������
B.����ɫ���岻�ܱ�������ľ̿��Ũ���ᷢ���˷�Ӧ
C.�ɢ�˵��Ũ������лӷ��ԣ����ɵĺ���ɫ����Ϊ��ԭ����
D.�۵���������м���CO2���ɴ�˵��ľ̿һ����Ũ���ᷢ���˷�Ӧ