题目内容
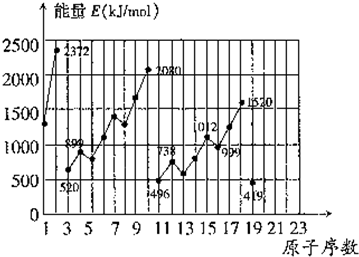
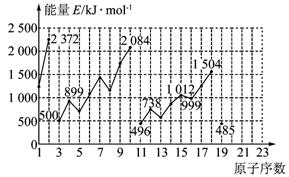
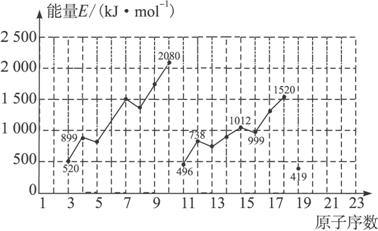
不同元素的气态原子失去最外层一个电子所需要的能量(设其为E)如图所示。试根据元素在周期表中的位置,分析图中曲线的变化特点,并完成下列问题:
(1)同主族内不同元素的E值变化的特点是:________________________。各主族中E值的这种变化特点体现了元素性质的________________变化规律。
(2)同周期内,随原子序数增大,E值增大。但个别元素的E值出现反常现象。试预测下列关系式中正确的是___________________(填写编号)。
①E(砷)>E(硒) ②E(砷)<E(硒) ③E(溴)>E(硒) ④E(溴)<E(硒)
(3)估计1mol气态Ca原子失去最外层一个电子所需能量E值的范围:__________<E<__________。
(4)10号元素E值较大的原因是___________________________________。
(1)随着原子序数增大,E值变小 周期性 (2)①③ (3)419 738〔E或填E(钾) E(镁)〕
(4)10号元素为氖。该元素原子的最外层电子排布已达到8电子稳定结构
解析:(1)分析图中数值,E(Li)>E(Na)>E(K),E(Be)>E(Mg),由此可见,同主族内不同元素的E值随着原子序数增大而减小,这也体现了元素性质的周期性变化规律。
(2)从两条曲线对应数值可看出,同一周期的ⅢA族和ⅥA族元素的E值与其相邻的元素的E值要低,因此第4周期的砷、硒、溴三元素,E(砷)>E(硒),E(溴)>E(硒)。
(3)由(1)、(2)结论知,E(Ca)<E(Mg),E(Ca)>E(K)。
(4)10号元素是稀有气体元素氖,其原子最外层已达到8个电子的稳定结构,失去一个电子需要较大能量。因此E值较大。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目