题目内容
【题目】依据下列热化学反应方程式作出的判断正确的是
①CH4(g) + ![]() O2(g)= CO (g)+ 2H2O(g)
O2(g)= CO (g)+ 2H2O(g) ![]() H1 = a kJ·mol-1
H1 = a kJ·mol-1
②CH4 (g)+ 2O2(g)= CO2(g) + 2H2O(g) ![]() H2 = b kJ·mol-1
H2 = b kJ·mol-1
③C (s)+ ![]() O2 (g) = CO (g)
O2 (g) = CO (g) ![]() H3= c kJ·mol-1
H3= c kJ·mol-1
④H2 (g)+ ![]() O2 (g)=H2O (l)
O2 (g)=H2O (l) ![]() H4 =d kJ·mol-1
H4 =d kJ·mol-1
A. a>b
B. a + c<b
C. 2CO (g)+O2 (g) =2CO2 (g)的![]() H =(b-a)kJ·mol-1
H =(b-a)kJ·mol-1
D. CO (g) + H2O (g)=CO2 (g)+H2 (g)的![]() H =(b-a-d)kJ·mol-1
H =(b-a-d)kJ·mol-1
【答案】A
【解析】A、反应①为1mol甲烷完全燃烧放出的热量,反应②为1mol甲烷不完全燃烧放出的热量,前者放出的热量较多,故a>b,选项A正确;B、反应①+③与②无法建立关系,故无法判断a + c和b的大小,选项B错误;C、根据盖斯定律,由②×2-①×2得反应2CO (g)+O2 (g) =2CO2 (g)的![]() H =2(b-a)kJ·mol-1,选项C错误;D、根据盖斯定律,由②-①-④得反应CO (g) + H2O (l)=CO2 (g)+H2 (g)的
H =2(b-a)kJ·mol-1,选项C错误;D、根据盖斯定律,由②-①-④得反应CO (g) + H2O (l)=CO2 (g)+H2 (g)的![]() H =(b-a-d)kJ·mol-1,选项D错误;答案选A。
H =(b-a-d)kJ·mol-1,选项D错误;答案选A。

 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案 期末集结号系列答案
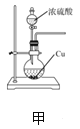
期末集结号系列答案【题目】用下图所示装置进行下列实验:将①中溶液滴入②中,预测的现象与实际相符的是( )

选项 | ①中物质 | ②中物质 | 预测②中的现象 |
A | 稀盐酸 | 碳酸钠与氢氧化钠的混合溶液 | 立即产生气泡 |
B | 浓硝酸 | 用砂纸打磨过的铝条 | 产生红棕色气体 |
C | 氯化铝溶液 | 浓氢氧化钠溶液 | 产生大量白色沉淀 |
D | 草酸溶液(H2C2O4具有还原性) | 高锰酸钾酸性溶液 | 溶液逐渐褪色 |
A. AB. BC. CD. D