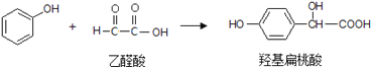
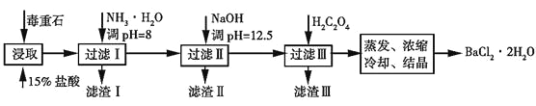
题目内容
【题目】用下图所示装置进行下列实验:将①中溶液滴入②中,预测的现象与实际相符的是( )

选项 | ①中物质 | ②中物质 | 预测②中的现象 |
A | 稀盐酸 | 碳酸钠与氢氧化钠的混合溶液 | 立即产生气泡 |
B | 浓硝酸 | 用砂纸打磨过的铝条 | 产生红棕色气体 |
C | 氯化铝溶液 | 浓氢氧化钠溶液 | 产生大量白色沉淀 |
D | 草酸溶液(H2C2O4具有还原性) | 高锰酸钾酸性溶液 | 溶液逐渐褪色 |
A. AB. BC. CD. D
【答案】D
【解析】
A.盐酸先与氢氧化钠反应,再与碳酸钠反应,所以反应初始时无气泡产生,故A错误;
B.浓硝酸能使金属铝钝化,不会产生大量红棕色气体,故B错误;
C.氯化铝溶液滴入氢氧化钠溶液中,氢氧化钠过量,氯化铝转化为偏铝酸钠,无白色沉淀生成,故C错误;
D.草酸具有还原性,能使高锰酸钾褪色,故D正确;
故选D。

 53随堂测系列答案
53随堂测系列答案【题目】下表是元素周期表的一部分,针对表中的①~⑨种元素,填写下列空白:
主族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
2 | ① | ② | ③ | |||||
3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
4 | ⑨ |
(1)写出元素符号和名称:
①________,②________,⑧________,⑨________。
(2)写出下列反应的化学方程式:
⑤的氧化物跟④的氢氧化物溶液反应:________________________________
⑥的单质在③的单质中燃烧:_____________________________________。
【题目】某含锰矿石的主要成分是MnO2,还含CaO、Al2O3、FeS杂质,由此矿石生产MnCO3的工艺流程如图所示:


已知:①相关金属离子生成氢氧化物沉淀的pH如表所示:
物质 | 开始沉淀 | 沉淀完全 |
Fe(OH)3 | 2.7 | 3.7 |
Al(OH)3 | 3.8 | 4.7 |
Mn(OH)2 | 8.8 | 10.4 |
Ca(OH)2 | 12 | ─ |
②常温下,Ksp(CaF2)=3.95×10-11
回答下列问题:
(1)酸溶时,是否能将稀硫酸换成浓盐酸______(填“是”或“否”);操作I的名称为______________。
(2)取溶液Ⅰ加入KSCN溶液,溶液呈血红色,试写出酸溶过程中MnO2与FeS发生反应的离子方程式:______。
(3)调节溶液Ⅰ的pH时,pH的范围为_________;所用的物质X最好是________(填字母)。
A.盐酸 B.NaOH溶液 C.氨水 D.MnCO3固体
(4)滤渣Ⅰ为___________________,滤渣Ⅱ为_____________。(填化学式)
(5)沉锰的化学方程式为_________________________________________。
(6)沉锰后过滤得到固体MnCO3,设计实验方案验证MnCO3固体是否洗涤干净:__________。