题目内容
【题目】某实验小组同学为了探究铜与浓硫酸的反应,进行了一系列实验。在反应过程中会发生一些副反应,生成不溶于水和酸的CuS、Cu2S。
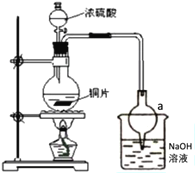
(1)处于安全和绿色化学考虑,在制取硫酸铜时,可选用下列的物质是____。
a.Cu b.CuO c.CuS d.CuSO4·Cu(OH)2H2O
(2)装置a的作用是___。反应过程中,因为浓硫酸的吸水作用,烧瓶中出现白色固体物质,如何简便检验反应后圆底烧瓶里有Cu2+存在?___。在实际反应中,由于条件控制不好,容易产生CuS和Cu2S固体:2CuS![]() Cu2S+S。
Cu2S+S。
(3)已知样品质量为ag,得到Cu2S是bg,则样品中CuS质量分数是___。如果Cu2S高温下转化为Cu,则实验测得的值会___(填“偏大”、“偏小”或“不变”)
(4)根据以上信息,说明铜与浓硫酸反应需要控制哪些条件?___
【答案】bd 防倒吸 将反应后的溶液沿烧杯壁缓缓倒入水中,若溶液变蓝,则有Cu2+存在 2(a-b)/a 偏大 温度不宜过高,时间不宜过长
【解析】
(1)a.铜和浓硫酸加热时反应才会制取硫酸铜,同时生成二氧化硫大气污染物,酸雨气体,故不选a;
b.氧化铜和稀硫酸反应生成硫酸铜和水,无污染物产生,b正确;
c. CuS 不溶于酸,要想制备硫酸铜,要先和氧气作用生成氧化铜和二氧化硫,2CuS + 3O2 →2CuO + 2SO2,氧化铜再和稀硫酸作用生成硫酸铜,该过程中产生二氧化硫大气污染物,故不选c;
d.CuSO4·Cu(OH)2H2O只需要和稀硫酸反应即可制取硫酸铜,无污染物产生,d正确;
综上分析正确答案选bd;
(2)二氧化硫被氢氧化钠溶液吸收,有压强差,使溶液产生倒吸,球形管有比较大的空间,防止形成过大的负压,可以防止倒吸;由于浓硫酸有吸水性,所不容易观察溶液颜色,需要将溶液稀释后检验铜离子是否存在,浓硫酸的稀释应注意酸入水,将原溶液注入水中进行稀释,如果溶液显蓝色则证明铜离子存在。
(3)设样品中CuS xg,Cu2S为yg,列方程组,质量守恒:x+y=a,铜原子守恒:(X/96+2y/160)/2=b/160,两个方程联立可解得x=6a-6b,所以样品中CuS的质量分数为:6a-6b/a。Cu2S在高温下会转化为Cu,则测的加热后固体的质量b偏小,根据方程式得出CuS的质量分数偏大。
(4)根据题意可以得出控制温度不能过高,加热时间不易太长。

【题目】一定条件下存在反应:CO(g)+H2O(g)![]() CO2(g)+H2(g),其正反应放热。现有三个相同的2L恒容绝热(与外界没有热量交换)密闭容器Ⅰ、Ⅱ、Ⅲ,各容器中充入的物质的物质的量如下表,700℃ 条件下开始反应。达到平衡时,下列说法正确的是
CO2(g)+H2(g),其正反应放热。现有三个相同的2L恒容绝热(与外界没有热量交换)密闭容器Ⅰ、Ⅱ、Ⅲ,各容器中充入的物质的物质的量如下表,700℃ 条件下开始反应。达到平衡时,下列说法正确的是
容器 | 充入容器中的物质的物质的量 |
Ⅰ | 1 mol CO和 1 mol H2O |
Ⅱ | 1 mol CO2和1 mol H2 |
Ⅲ | 2 mol CO和2 mol H2O |
A. 容器Ⅰ、Ⅱ中正反应速率相同
B. 容器Ⅰ、Ⅲ中反应的平衡常数相同
C. 容器Ⅰ中CO的物质的量比容器Ⅱ中的少
D. 容器Ⅰ中CO的转化率与容器Ⅱ中CO2 的转化率之和小于1