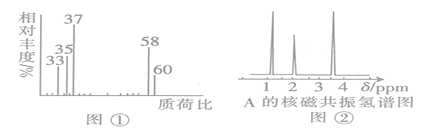
题目内容
【题目】一定条件下存在反应:CO(g)+H2O(g)![]() CO2(g)+H2(g),其正反应放热。现有三个相同的2L恒容绝热(与外界没有热量交换)密闭容器Ⅰ、Ⅱ、Ⅲ,各容器中充入的物质的物质的量如下表,700℃ 条件下开始反应。达到平衡时,下列说法正确的是
CO2(g)+H2(g),其正反应放热。现有三个相同的2L恒容绝热(与外界没有热量交换)密闭容器Ⅰ、Ⅱ、Ⅲ,各容器中充入的物质的物质的量如下表,700℃ 条件下开始反应。达到平衡时,下列说法正确的是
容器 | 充入容器中的物质的物质的量 |
Ⅰ | 1 mol CO和 1 mol H2O |
Ⅱ | 1 mol CO2和1 mol H2 |
Ⅲ | 2 mol CO和2 mol H2O |
A. 容器Ⅰ、Ⅱ中正反应速率相同
B. 容器Ⅰ、Ⅲ中反应的平衡常数相同
C. 容器Ⅰ中CO的物质的量比容器Ⅱ中的少
D. 容器Ⅰ中CO的转化率与容器Ⅱ中CO2 的转化率之和小于1
【答案】D
【解析】
A.在I中充入1molCO和1molH2O,在II中充入1molCO2和1mol H2,刚开始时,容器I中正反应速率最大,容器II中正反应速率为零,达到平衡时,容器I温度大于700℃,容器II温度小于700℃,所以容器Ⅰ中的正反应速率大于容器Ⅱ中正反应速率,A错误;
B.容器III可看成容器I体积压缩一半,各物质浓度增加一倍,若温度恒定,则平衡不移动;但恒容绝热的情况下,容器III中温度比容器I高,更有利于平衡向逆反应方向移动,升高温度,平衡向吸热的逆反应方向移动,所以化学平衡常数K(I)>K(III),B错误;
C.容器Ⅰ从正反应方向开始,容器III从逆反应方向开始,由于该反应的正反应为放热反应,所以反应达到平衡时,容器Ⅰ的温度高于容器II,升高温度,化学平衡逆向移动,因此I中CO的物质的量比容器Ⅱ中的多,C错误;
D.根据选项C可知容器I、II的温度不相同,容器I的温度高于700℃,容器II温度低于700℃。若容器II的温度也是700℃,一个从正反应方向开始,一个从逆反应方向开始,I中CO的转化率与容器Ⅱ中CO2 的转化率之和等于1,但容器II温度低于700℃,降低温度,平衡正向移动,使CO2的转化率降低,因此容器Ⅰ中CO的转化率与容器Ⅱ中CO2 的转化率之和小于1,D正确;
故合理选项是D。

【题目】合成气的主要组分为CO和H2;以天然气为原料生产的合成气有多种方法,其中Sparg工艺的原理为CH4(g)+CO2(g)2CO(g)+2H2(g)。在特定温度下,向甲、乙、丙三个密闭容器中充入相同量的CH4(g)和CO2(g),改变容器体积,测得平衡时容器内气体的浓度如下表所示:
实验编号 | 容器温度/℃ | 容器体积 | 物质浓度/(mol·L-1) | ||
CH4 | CO2 | CO | |||
甲 | 300 | V1 | 0.02 | 0.02 | 0.10 |
乙 | 300 | V2 | x | x | 0.05 |
丙 | 350 | V1 | y | y | 0.12 |
下列说法正确的是( )
A.该反应在低温条件下不能自发进行
B.300 ℃时反应的平衡常数为25
C.V1∶V2=3∶7
D.保持温度和容器体积不变,开始时向甲容器中充入0.28 mol CO和0.28 mol H2,CO转化率一定大于2/7