题目内容
14. 用1.0mol•L-1 NaOH溶液中和某浓度硫酸溶液时,其pH和所加NaOH溶液的体积关系如图所示.原硫酸溶液的物质的量浓度和完全反应后溶液的总体积是( )
用1.0mol•L-1 NaOH溶液中和某浓度硫酸溶液时,其pH和所加NaOH溶液的体积关系如图所示.原硫酸溶液的物质的量浓度和完全反应后溶液的总体积是( )| A. | 1mol•L-1,60mL | B. | 0.5mol•L-1,80mL | C. | 0.5mol•L-1,40mL | D. | 1mol•L-1.80mL |
分析 根据硫酸溶液的pH确定氢离子浓度,再根据硫酸和氢离子之间的关系式确定硫酸浓度;根据硫酸和氢氧化钠反应的关系式计算氢氧化钠溶液的体积,硫酸和氢氧化钠溶液体积就是完全反应后溶液的总体积.
解答 解:根据图象知,硫酸的pH=0,则c(H+)=1mol/L,c(H2SO4)=$\frac{1}{2}$c(H+)=0.5mol/L;完全反应时氢氧化钠溶液的体积为40mL,根据反应中氢氧化钠和硫酸的关系式得:n(NaOH)=2n(H2SO4)=2×0.5mol/L×0.04L=1mol/L×V,所以V(NaOH)=$\frac{2×0.5mol/L×0.04L}{1mol/L}$=40mL,则混合溶液体积=40mL×2=80mL,
故选B.
点评 本题考查了物质的量的有关计算,根据曲线中pH确定硫酸浓度,再结合硫酸和氢氧化钠的关系式进行解答,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
4.下列关于工业生产的叙述中,不正确的是( )
| A. | 目前工业上主要采用接触法制硫酸,并使用热交换器充分利用反应中放出的热量 | |
| B. | 从海水中提取溴,是将提取粗盐后的母液浓缩、氧化,使溶液中的溴离子发生氧化反应转化成溴单质,就得到粗溴 | |
| C. | 工业上合成氨没有采用更大的压强是从设备和动力要求方面考虑的 | |
| D. | 离子交换膜在工业生产中广泛应用,如氯碱工业使用了阳离子交换膜 |
5.下列物质中,不属于电解质的是( )
| A. | NaCl | B. | 盐酸 | C. | H2SO4 | D. | KOH |
2.下列是一些物质粒子的示意图:其中可能属于氧化物的是( )
| A. | 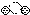 | B. | 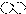 | C. |  | D. |  |
9.设NA为阿伏伽德罗常数的值.下列说法正确的是( )
| A. | 标准状况下,2.24L氯气溶于水发生反应,转移的电子数目为0.1NA | |
| B. | 常温常压下,16g O2和O3混合气体中,含氧原子的总数为1NA | |
| C. | 1L1 mol•L-1的NH4NO3溶液中含有NH4+数目为NA | |
| D. | 25℃时,pH=13的Ba(OH)2溶液中OH-的数目为0.01NA |
19.已知X、Y、Z、W为原子序数依次增大的短周期主族元素,Z+与X3一具有相同的电子层结构,Y、W原子的价电子数目之和为13.下列有关说法中正确的是( )
| A. | 四种元素的原子半径:Z<Y<X<W | |
| B. | 化合物Z3X与ZX3中的化学键类型相同 | |
| C. | X与W两种元素的最简单氢化物间能发生化合反应 | |
| D. | 常温下,X和Y形成的所有单质均为无色气体 |
3. 短周期元素X、Y、Z、W的原子序数依次增加,其中一种为金属元素.Y元素在大气中存在两种常见单质,Z与X处于同一主族,q、r、s是由这些元素组成的二元化合物,m、n、p分别是元素Z、X、W的单质,p通常为黄绿色气体.上述物质的转化关系如图所示.下列说法正确的是( )
短周期元素X、Y、Z、W的原子序数依次增加,其中一种为金属元素.Y元素在大气中存在两种常见单质,Z与X处于同一主族,q、r、s是由这些元素组成的二元化合物,m、n、p分别是元素Z、X、W的单质,p通常为黄绿色气体.上述物质的转化关系如图所示.下列说法正确的是( )
 短周期元素X、Y、Z、W的原子序数依次增加,其中一种为金属元素.Y元素在大气中存在两种常见单质,Z与X处于同一主族,q、r、s是由这些元素组成的二元化合物,m、n、p分别是元素Z、X、W的单质,p通常为黄绿色气体.上述物质的转化关系如图所示.下列说法正确的是( )
短周期元素X、Y、Z、W的原子序数依次增加,其中一种为金属元素.Y元素在大气中存在两种常见单质,Z与X处于同一主族,q、r、s是由这些元素组成的二元化合物,m、n、p分别是元素Z、X、W的单质,p通常为黄绿色气体.上述物质的转化关系如图所示.下列说法正确的是( )| A. | 化合物Z2Y2与X2Y2中化学键完全相同 | |
| B. | 最简单氢化物的沸点:Y>W | |
| C. | 36g物质q与过量的物质r反应则有2mol电子发生转移 | |
| D. | 由Y、Z、W三种元素组成的化合物的水溶液一定显中性 |
4.下列事实能用勒夏特列原理解释的是( )
| A. | 使用催化剂,在单位时间内提高合成氨产率 | |
| B. | 对于2HI(g)?H2(g)+2CO(g),达平衡后.缩小容器体积可使体系颇色变深 | |
| C. | 对于2CaO2(s)?2CaO(s)+O2(g),达平衡后增大压强,再次平衡后O2的浓度保持不变 | |
| D. | 溴水中有下列平衡:Br(aq)+H2O(l)?HBr(aq)+HBrO(aq)当加入硝酸银溶液后,溶液颜色变浅 |