题目内容
2.下列是一些物质粒子的示意图:其中可能属于氧化物的是( )| A. | 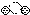 | B. | 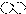 | C. |  | D. |  |
分析 根据物质的粒子的示意图,分析粒子的构成,判断符合氧化物分子构成特点--含两种原子且含氧原子的粒子示意图.
解答 解:在四种物质粒子的示意图中,A粒子由两种原子构成,与氧化物的分子构成最为相似;而B粒子、D粒子都是由同种原子构成、C粒子是由三种不同的原子构成,与两种原子构成的氧化物分子的特点明显不同;因此,四种粒子中可能属于氧化物的只有A粒子.
故选A.
点评 本题考查了模型表示的结构,氧化物是由两种元素组成且含氧元素的化合物,因此,氧化物的分子应含有两种原子并且其中必须含有氧原子,题目难度中等.

练习册系列答案
相关题目
20.在一定条件下,将C(s)和H2O(g)分别加入甲、乙两个密闭容器,发生反应:C(s)+2H2O(g)?CO2(g)+2H2(g),其相关数据如表所示:
(1)T1>T2(填“>”、“<”或“=”)
(2)达到平衡后,保持温度和体积不变,向甲容器内再充入0.8molH2O和3.2molH2,则此时V正=V逆
(填“>”、“<”或“=”)
(3)在密闭恒容的容器中,能表示上述反应达到化学平衡状态的是BD.
A.V逆(CO2)═2V正(H2)
B.混合气体的密度保持不变
C.c(H2O):c(CO2):c(H2)=2:1:2
D.混合气体的平均相对分子质量保持不变
(4)某同学为了研究反应条件对化学平衡的影响,测得逆反应速率与时间的关系如图所示:

可见在t1、t3、t5、t7时反应都达了到平衡状态,如果t2、t4、t6、t8时都只改变了一个反应条件,则t6时刻改变的条件是通入H2O,则从t1到t8哪个时间段H2O (g)的平衡转化率最低t7-t8,(填“t1~t2,以此类推”).
| 容器 | 容积/L | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | |
| C(s) | H2O(g) | H2(g) | ||||
| 甲 | 2 | T1 | 2 | 4 | 3.2 | 2.8 |
| 乙 | 1 | T2 | 1 | 2 | 1.2 | 3.0 |
(2)达到平衡后,保持温度和体积不变,向甲容器内再充入0.8molH2O和3.2molH2,则此时V正=V逆
(填“>”、“<”或“=”)
(3)在密闭恒容的容器中,能表示上述反应达到化学平衡状态的是BD.
A.V逆(CO2)═2V正(H2)
B.混合气体的密度保持不变
C.c(H2O):c(CO2):c(H2)=2:1:2
D.混合气体的平均相对分子质量保持不变
(4)某同学为了研究反应条件对化学平衡的影响,测得逆反应速率与时间的关系如图所示:

可见在t1、t3、t5、t7时反应都达了到平衡状态,如果t2、t4、t6、t8时都只改变了一个反应条件,则t6时刻改变的条件是通入H2O,则从t1到t8哪个时间段H2O (g)的平衡转化率最低t7-t8,(填“t1~t2,以此类推”).
13.下列实验目的无法实现的是( )
| A. | 用激光笔光束鉴别氯化铁溶液和氢氧化铁胶体 | |
| B. | 用KSCN溶液鉴别Fe3+和Fe2+ | |
| C. | 用NaOH溶液和红色石蕊试纸鉴别溶液是否含NH4+ | |
| D. | 在氢氧化钠溶液中滴入氯化铁饱和溶液可以制得氢氧化铁胶体 |
10.高纯度单晶硅是典型的无机非金属材料,又称“半导体”材料,它的发现和使用曾引起计算机的一场“革命”.这种材料可以按下列方法制备:
SiO2$→_{高温}^{①C}$Si(粗)$→_{300℃}^{②HCl}$SiHCl3$→_{1000-1100℃}^{③过量H_{2}}$Si(纯)下列说法正确的是( )
SiO2$→_{高温}^{①C}$Si(粗)$→_{300℃}^{②HCl}$SiHCl3$→_{1000-1100℃}^{③过量H_{2}}$Si(纯)下列说法正确的是( )
| A. | 步骤①的化学方程式为SiO2+C$\frac{\underline{\;高温\;}}{\;}$Si+CO2↑ | |
| B. | 步骤①②③中每生成或反应1 mol Si,转移4 mol 电子 | |
| C. | 二氧化硅能与氢氟酸反应,也能与氢氧化钠溶液反应,属于两性氧化物 | |
| D. | SiHCl3(沸点33.0℃)中含有少量的SiCl4(沸点67.6℃),通过蒸馏(或分馏)可提纯SiHCl3 |
17.常温下,有体积均为10mL、pH均等于1的盐酸和醋酸溶液,下列说法正确的是( )
| A. | 上述两种溶液分别用水稀释m、n倍,溶液的pH都变成3,则m>n | |
| B. | 上述两种溶液分别与足量的Zn完全反应,产生的H2一样多 | |
| C. | 上述两种溶液分别与等浓度的氢氧化钠溶液恰好反应,消耗氢氧化钠溶液的体积相同 | |
| D. | 1mol/L的盐酸和1mol/L的醋酸的混合溶液与氢氧化钠溶液恰好完全反应时,反应后溶液中c(CH3COO-)+C(Cl-)<c(Na+) |
7.设NA表示阿伏加德罗常数,下列说法正确的是( )
| A. | 23 g钠与足量氧气充分反应,转移的电子个数为NA | |
| B. | 1mol Cl2与水充分反应,转移的电子个数为NA | |
| C. | 1mol Na2O2与水完全反应时转移电子数为2NA | |
| D. | 18 g H2O含有的电子数为18NA |
14. 用1.0mol•L-1 NaOH溶液中和某浓度硫酸溶液时,其pH和所加NaOH溶液的体积关系如图所示.原硫酸溶液的物质的量浓度和完全反应后溶液的总体积是( )
用1.0mol•L-1 NaOH溶液中和某浓度硫酸溶液时,其pH和所加NaOH溶液的体积关系如图所示.原硫酸溶液的物质的量浓度和完全反应后溶液的总体积是( )
 用1.0mol•L-1 NaOH溶液中和某浓度硫酸溶液时,其pH和所加NaOH溶液的体积关系如图所示.原硫酸溶液的物质的量浓度和完全反应后溶液的总体积是( )
用1.0mol•L-1 NaOH溶液中和某浓度硫酸溶液时,其pH和所加NaOH溶液的体积关系如图所示.原硫酸溶液的物质的量浓度和完全反应后溶液的总体积是( )| A. | 1mol•L-1,60mL | B. | 0.5mol•L-1,80mL | C. | 0.5mol•L-1,40mL | D. | 1mol•L-1.80mL |
11.如图所示的实验操作中,正确的是( )
| A. |  | B. | 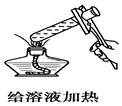 | C. | 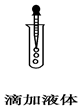 | D. |  |