题目内容
(5分)1 mol CH4气体完全燃烧放出的热量为802 kJ,但当不完全燃烧生成CO气体和液态H2O时,放出的热量为519 kJ。如果1 mol CH4与n g O2燃烧生成CO、CO2气体和液态H2O,放出731.25 kJ热量。
(1)写出CH4气体不完全燃烧的热化学方程式。
(2)计算n的值。
(1)写出CH4气体不完全燃烧的热化学方程式。
(2)计算n的值。
(1)2CH4(g)+3O2(g)====2CO(g)+4H2O(l);ΔH="-1038" kJ·mol -1
或CH4(g)+3/2O2(g)====CO(g)+2H2O(l);ΔH="-519" kJ·mol-1
(2)n=60
或CH4(g)+3/2O2(g)====CO(g)+2H2O(l);ΔH="-519" kJ·mol-1
(2)n=60
由题意书写为完全燃烧的热化学方程式为:2CH4 (g)+3O2 (g)====2CO(g)+4H2O(l);ΔH="-1038" kJ·mol-1
或CH4 (g)+3/2O2 (g)====CO(g)+2H2O(l);ΔH="-519" kJ·mol-1①,同理完全燃烧的热化学方程式为:CH4 (g)+2O2 (g)====CO2 (g)+2H2O(l);ΔH="-802" kJ·mol-1②
可设不完全燃烧、完全燃烧的CH4的物质的量分别是x、y,由①②得
CH4 — 3/2O2 — CO — 519 kJ
x x·3/2 519x kJ
CH4 — 2O2 — CO2 — 802 kJ
Y 2y 802y kJ
得关系式x+y="1" mol
x·3/2+2y="n/32" mol
519x kJ+802y kJ="731.25" kJ
解得:x="0.25" mol y="0.75" mol n=60。
或CH4 (g)+3/2O2 (g)====CO(g)+2H2O(l);ΔH="-519" kJ·mol-1①,同理完全燃烧的热化学方程式为:CH4 (g)+2O2 (g)====CO2 (g)+2H2O(l);ΔH="-802" kJ·mol-1②
可设不完全燃烧、完全燃烧的CH4的物质的量分别是x、y,由①②得
CH4 — 3/2O2 — CO — 519 kJ
x x·3/2 519x kJ
CH4 — 2O2 — CO2 — 802 kJ
Y 2y 802y kJ
得关系式x+y="1" mol
x·3/2+2y="n/32" mol
519x kJ+802y kJ="731.25" kJ
解得:x="0.25" mol y="0.75" mol n=60。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
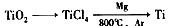
 C(s)+
C(s)+ 
 O2 ( g )+2H2O ( l)△H=一867 kJ·mol-1
O2 ( g )+2H2O ( l)△H=一867 kJ·mol-1 -1
-1