题目内容
| A.C+H2O |
| B.C(s)+H2O(g) |
| C.C(s)+H2O(g) |
D.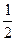 C(s)+ C(s)+ 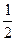 H2O(g) H2O(g)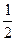 CO(g)+ CO(g)+ 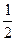 H2(g); △H=+65.64kJ/mol H2(g); △H=+65.64kJ/mol |
D
A项未标明物质的聚集状态,?H的值也不对,B、C项的?H值均不对。

练习册系列答案
 中考解读考点精练系列答案
中考解读考点精练系列答案
相关题目
题目内容
| A.C+H2O |
| B.C(s)+H2O(g) |
| C.C(s)+H2O(g) |
D.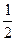 C(s)+ C(s)+ 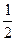 H2O(g) H2O(g)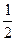 CO(g)+ CO(g)+ 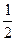 H2(g); △H=+65.64kJ/mol H2(g); △H=+65.64kJ/mol |

 中考解读考点精练系列答案
中考解读考点精练系列答案