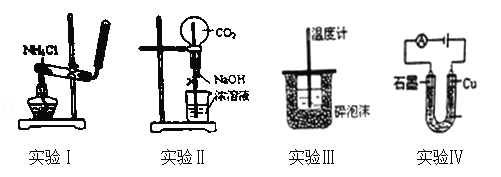
��Ŀ����
����Ŀ��Ԫ��Xλ�ڵ������ڣ����̬ԭ�ӵ��ڲ���ȫ���������ӣ�������������Ϊ1��Ԫ��Y��̬ԭ�ӵ�3p�������5�����ӣ�Ԫ��Z��ԭ�����������������ڲ��������3����Ԫ��W��̬ԭ�ӵĺ�����ӹ���16���˶�״̬��
��1������Ԫ�����ڱ��У�Ԫ��Xλ�� ����Ԫ��Y�����ڱ��е�λ���� ��
��Z���������У���һ����������Ԫ���� ����Ԫ�����ƣ���
��X+�ĺ�������Ų�ʽΪ ��
��Y��W��Ԫ������������Ӧ��ˮ�������Խ�ǿ���� ���ѧʽ����
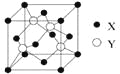
��2��X��Y���γɻ����ᄃ��ľ�������ͼ��ʾ����1�������У�X���ӵ���ĿΪ ���û�����Ļ�ѧʽΪ ��
��3�������Ҵ��е��ܽ�ȣ�Z���⻯��(H2Z)����H2W������Ҫԭ���� ��
���ȶ��ԣ�H2Z H2W����������������������=����������Ҫԭ���� ��
���𰸡���1����ds ����������A��������1s22s22p63s23p63d10��HClO4��2��4 CuCl��3���� ˮ���Ӻ��Ҵ������о����ǻ�ʹ��ˮ�������Ҵ����Ӽ����γ������2�֣��������Ӽ��������ֲ��÷֣� ������1�֣� ��Ԫ�طǽ����Դ�����Ԫ�صķǽ����ԣ���H2O������H-O�ļ��ܴ���H2S������H-S�ļ��ܣ���H-O���ļ���С��H-S���ļ���������1��)
�����������������Ԫ��X λ�ڵ������ڣ����̬ԭ�ӵ��ڲ���ȫ���������ӣ����ڲ������=2+8+18=28��������������Ϊ1�����Ը�ԭ����29�����ӣ�ΪCuԪ�أ�Ԫ��Y��̬ԭ�ӵ�3p�������5�����ӣ���Y��ClԪ�أ�Ԫ��Z��ԭ�����������������ڲ��3����Ԫ������������С�ڻ����8������Z��OԪ�أ�Ԫ��W��̬ԭ�ӵĺ�����ӹ���16���˶�״̬����W��SԪ�أ�����XΪͭ��YΪ�ȣ�ZΪ����WΪ��
��1����Ԫ��YΪCl��Cl��3�����Ӳ㣬�����7�����ӣ��ʴ������ڱ��е������ڵ���A�壬Ԫ��XΪCu���������ڱ���ds����
����Ԫ����������Ϊ�ڶ����ڣ����е�һ����������Ԫ�����ʡ�
��XΪCu��Cu��ԭ������Ϊ29��Ϊ�������ڵ���B��Ԫ�أ�Cu+�ĺ�������Ų�ʽΪ1s22s22p63s23p63d10��
��Cl��S��Ԫ�����γɵ�����������Ӧ��ˮ����ֱ�ΪH2SO4��HClO4��Ԫ�صķǽ�����Խǿ�������������ˮ���������Խǿ�����ڷǽ�����Cl��S�������Խ�ǿ����HClO4��
��2����Cu��Cl���γɻ����ᄃ��ľ�����ͼ��ʾ��1��������CuΪ��8��![]() +6��
+6��![]() =4��
=4��
��Cl����Ϊ4���ʴ˾�����Cu��Cl�ĸ�����Ϊ1��1���ʻ�ѧʽΪ��CuCl��
��3����ˮ�������Ҵ����Ӽ����γ��������ˮ���Ӻ��Ҵ������о����ǻ����������Ҵ��е��ܽ�ȣ�Z���⻯��(H2O)����H2S����H2O������H-O�ļ��ܴ���H2S������H-S�ļ��ܣ�����ˮ���ӵ��ȶ���ǿ��H2S��

 ����ѧ����ϵ�д�
����ѧ����ϵ�д�����Ŀ��ij̽��С����HNO3 �����ʯ��Ӧ������������С�ķ����о�Ӱ�췴Ӧ���ʵ����ء�����HNO3Ũ��Ϊ1.00mol/L��2.00mol/L������ʯ��ϸ������ֿ������ֹ��ʵ���¶�Ϊ298K��308K��ÿ��ʵ��HN03 ������Ϊ25.0mL������ʯ����Ϊ10.00g��
��1�����������ʵ����Ʊ�����ʵ��Ŀ��һ���������Ӧ��ʵ���ţ�
������ | T/K | ����ʯ��� | HNO3Ũ��mol/L | ʵ��Ŀ�� |
�� | 298 | �ֿ��� | 2.00 | ʵ��ٺ͢�̽��HNO3 Ũ�ȶԸ÷�Ӧ���ʵ�Ӱ�죻 (II��ʵ��ٺ�____̽���¶ȶԸ÷�Ӧ���ʵ�Ӱ�죻 (III)ʵ��ٺ�____̽������ʯ��֡�ϸ���Ը÷�Ӧ���ʵ�Ӱ�졣 |
�� | 298 | �ֿ��� | 1.00 | |
�� | 308 | �ֿ��� | 2.00 | |
�� | 298 | ϸ���� | 2.00 |
��2��ʵ�����CO2������ʱ��仯�Ĺ�ϵ��ͼ��

���ݷ�Ӧ����ʽCaCO3+2HNO3=Ca(NO3)2+CO2��+H2O������ʵ�����70��90s��Χ��HNO3��ƽ����Ӧ����_______����������Һ����仯��
��3��������ͼ�У�����ʵ��ں͢���CO2������ʱ��仯��ϵ��Ԥ�ڽ��ʾ��ͼ��������ߵ����_______��
��4����ҵ�ϼ�ʵ��CO2��H2��Ӧ���ɼ״���ת������֪����һ���¡������ܱ������г���1mol CO2��3molH2��һ�������·�����Ӧ��CO2(g)+3H2(g)=CH3OH(g)+H2O(g)�����CO2��CH3OH (g)��Ũ����ʱ��仯����ͼ��ʾ����ش�
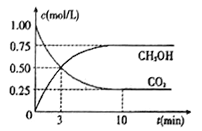
�ٴﵽƽ��ʱH2��ת����Ϊ_______����ǰ10min�ڣ���CO2��ʾ�ķ�Ӧ���ʣ�V(CO2)=______mol/(L��min)
�����жϸ÷�Ӧ�ﵽ��ѧƽ��״̬��������_______��
a������ѹǿ���� b�����������c(CO2)����
c. v(CH3OH)��v(H2O) d. c(CH3OH)=c(H2O)
����Ŀ����һ����ɱ���ܱ������У�����һ������X��Y��Z��������ӦmX��g����nY��g��![]() pZ��g����H��QkJ��mol��1����Ӧ�ﵽƽ���Y�����ʵ���Ũ�����¶ȡ���������Ĺ�ϵ���±���ʾ��
pZ��g����H��QkJ��mol��1����Ӧ�ﵽƽ���Y�����ʵ���Ũ�����¶ȡ���������Ĺ�ϵ���±���ʾ��
�������/L c(Y)/(mol��L-1) �¶�/�� | 1 | 2 | 3 |
100 | 1.00 | 0.75 | 0.53 |
200 | 1.20 | 0.90 | 0.63 |
300 | 1.30 | 1.00 | 0.70 |
����˵������ȷ����
A. m��n��p
B. Q��0
C. ������䣬�¶����ߣ�ƽ�����淴Ӧ�����ƶ�
D. �¶Ȳ��䣬ѹǿ����Y��������������