题目内容
【题目】某探究小组用HNO3 与大理石反应过程中质量减小的方法研究影响反应速率的因素。所用HNO3浓度为1.00mol/L、2.00mol/L,大理石有细颗粒与粗颗粒两种规格,实验温度为298K、308K,每次实验HN03 的用量为25.0mL、大理石用量为10.00g。
(1)请完成以下实验设计表,在实验目的一栏中填出对应的实验编号:
试验编号 | T/K | 大理石规格 | HNO3浓度mol/L | 实验目的 |
① | 298 | 粗颗粒 | 2.00 | 实验①和②探究HNO3 浓度对该反应速率的影响; (II)实验①和____探究温度对该反应速率的影响; (III)实验①和____探究大理石规格(粗、细)对该反应速率的影响。 |
② | 298 | 粗颗粒 | 1.00 | |
③ | 308 | 粗颗粒 | 2.00 | |
④ | 298 | 细颗粒 | 2.00 |
(2)实验①中CO2质量随时间变化的关系见图:

依据反应方程式CaCO3+2HNO3=Ca(NO3)2+CO2↑+H2O,计算实验①在70~90s范围内HNO3的平均反应速率_______。(忽略溶液体积变化)
(3)请在上图中,画出实验②和③中CO2质量随时间变化关系的预期结果示意图,并标出线的序号_______。
(4)工业上己实现CO2和H2反应生成甲醇的转化。己知:在一恒温、恒容密闭容器中充入1mol CO2和3molH2,一定条件下发生反应:CO2(g)+3H2(g)=CH3OH(g)+H2O(g)。测得CO2和CH3OH (g)的浓度随时间变化如下图所示。请回答:
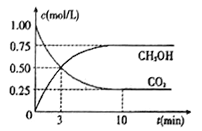
①达到平衡时H2的转化率为_______。在前10min内,用CO2表示的反应速率:V(CO2)=______mol/(L·min)
②能判断该反应达到化学平衡状态的依据是_______。
a.容器压强不变 b.混合气体中c(CO2)不变
c. v(CH3OH)=v(H2O) d. c(CH3OH)=c(H2O)
【答案】 ③④ 0.009(或0.01)mol/(L·s)  75% 0.075 a b
75% 0.075 a b
【解析】(1)由实验目的可知,探究浓度、接触面积、温度对化学反应速率的影响,实验①和②探究HNO3 浓度对该反应速率的影响,则变量是硝酸浓度;实验①③中只有温度不同,探究温度对该反应速率的影响;实验①④的温度、硝酸浓度相同,大理石规格不同,探究大理石规格(粗、细)对该反应速率的影响。(2)由图可知70至90S,CO2生成的质量为m(CO2)=0.95g-0.84g=0.11g,物质的量为n(CO2)=0.0025mol,由CaCO3+2HNO3=Ca(NO3)2+CO2↑+H2O可知消耗HNO3的物质的量为n(HNO3)=0.025mol×2=0.05mol,又溶液体积为25ml=0.025L,所以HNO3减少的浓度△c(HNO3)=0.2molL-1,反应的时间t=90s-70s=20s,所以HNO3在70-90S范围内的平均反应速率为v(HNO3)=△c/△t=0.01mol/(L·s);(3)由于②硝酸浓度是①的一半,所以反应速率比①小,生成的二氧化碳是①的一半;③中的硝酸浓度与①相同,所以生成的二氧化碳物质的量相等,但是温度③最高,反应速率最快,
根据以上画出实验②和③中CO2质量随时间变化关系的预期结果示意图为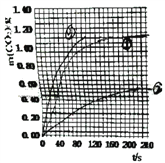 。4)①达到平衡时生成甲醇是0.75mol/L,消耗氢气是2.25mol/L,所以H2的转化率为2.25/3×100%=75%。在前10min内消耗CO2是1mol/L-0.25mol/L=0.75mol/L,因此用CO2表示的反应速率:V(CO2)=0.75mol/L÷10min=0.075mol/(L·min);②a.正反应体积减小,则容器压强不变说明反应达到平衡状态,a正确;b.混合气体中c(CO2)不变明反应达到平衡状态,b正确;c. v(CH3OH)=v(H2O)不能说明正逆反应速率相等,不一定处于平衡状态,c错误;d.c(CH3OH)=c(H2O) 不能说明正逆反应速率相等,不一定处于平衡状态,d错误,答案选ab。
。4)①达到平衡时生成甲醇是0.75mol/L,消耗氢气是2.25mol/L,所以H2的转化率为2.25/3×100%=75%。在前10min内消耗CO2是1mol/L-0.25mol/L=0.75mol/L,因此用CO2表示的反应速率:V(CO2)=0.75mol/L÷10min=0.075mol/(L·min);②a.正反应体积减小,则容器压强不变说明反应达到平衡状态,a正确;b.混合气体中c(CO2)不变明反应达到平衡状态,b正确;c. v(CH3OH)=v(H2O)不能说明正逆反应速率相等,不一定处于平衡状态,c错误;d.c(CH3OH)=c(H2O) 不能说明正逆反应速率相等,不一定处于平衡状态,d错误,答案选ab。

 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案【题目】化学与社会、生活密切相关。对下列现象或事实的解释正确的是
选项 | 现象或事实 | 解释 |
A | 用热的纯碱溶液洗去油污 | Na2CO3可直接和油污反应 |
B | 漂白粉在空气中久置变质 | 漂白粉中的CaCl2 与空气中的CO2反应生成CaCO3 |
C | 施肥时,草木灰(有效成分为K2CO3)不能与NH4Cl混合使用 | K2CO3与NH4Cl反应生成氨气会降低肥效 |
D | FeCl3溶液可用于铜质印刷线路板制作 | FeCl3能从含有Cu2+的溶液中置换出铜 |