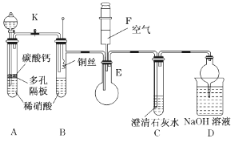
题目内容
【题目】常温下,用0.01mol/L的NaOH溶液滴定某浓度的H2N2O2(二元弱酸)溶液,所得溶液中H2N2O2、HN2O2-、N2O22-三种微粒的物质的量分数(δ)与溶液PH的关系如图所示。则下列说法中正确的是
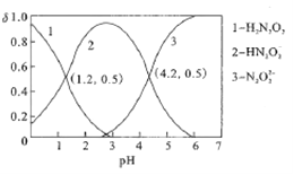
A. 该滴定过程应该选择甲基橙作为指示剂
B. Ka1(H2N2O2)的数量级为10-4.2
C. pH=1.2溶液中:c(Na+)+c(H+)=c(OH-)+c(H2N2O2)
D. pH=4.2溶液中:c(Na+)>2c(N2O22-)+c(HN2O2-)
【答案】C
【解析】A、用强碱NaOH滴定H2N2O2,应用酚酞做指示剂,故A错误;B、PH=1.2时,c(HN2O2-)=c(H2N2O2),Ka1(H2N2O2)=c(H+)c(HN2O2-)/c(H2N2O2)=c(H+)=10-1.2,Ka1(H2N2O2)的数量级为10-1.2,故B错误;C、pH=1.2,c(HN2O2-)=c(H2N2O2),溶液中存在电荷守恒:c(Na+)+c(H+)=c(OH-)+c(HN2O2-)=c(OH-)+c(H2N2O2),故C正确;D、pH=4.2溶液中:c(Na+)+c(H+)=c(OH-)+2c(N2O22-)+c(HN2O2-),溶液呈酸性,c(Na+)<2c(N2O22-)+c(HN2O2-),故D错误;故选C。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目