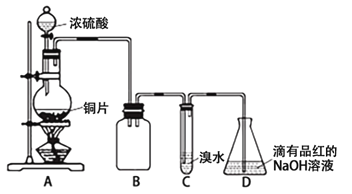
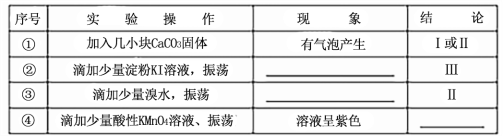
��Ŀ����
����Ŀ������һ�ֺ��нᾧˮ���Σ���A��B��C��D��E����Ԫ����ɣ����������Ƕ�����Ԫ�ء�������ˮ��ɵ�������������Ӻ�һ�������ӣ�����A��B��Ԫ�ؿ��γ�10���ӵ������ӡ�AԪ��ԭ�Ӻ�����������E����1��D��E����ͬ���塣
�ü�������ʵ�飺
��ȡ�����ľ�����������ˮ�����Һ��
��ȡ��������Һ���Թ��е���KSCN��Һ���������ٵ�����������������Һ���ʺ�ɫ��
��ȡ��������Һ���Թ��У������м���ϡ������ټ���BaCl2��Һ�����ְ�ɫ������
��ȡ��������Һ���Թ��м�������NaOH��Һ�����ȣ�
�ش��������⣺
��1��ʵ������֤����Һ�к��� ��
��2�������ӷ���ʽ��ʾʵ�����������ԭ�� �� ��
��3��ʵ�����г��ֵ������� ��
��4�����ⶨ�����Ħ������Ϊ392 g/mol�����������������������ʵ���֮��Ϊ3:2�������Ļ�ѧʽΪ ��
���𰸡���1��SO42������2��H2O2+2Fe2++2H+==2H2O+2Fe3+��Fe3++3SCN-![]() Fe(SCN)3����3���а�ɫ��״�������ɣ�Ѹ�ٱ�ɻ���ɫ�����ձ�ɺ��ɫ�������д����̼�����ζ�������ɣ�������ʹʪ��ĺ�ɫʯ����ֽ�������������ɣ�����4��(NH4)2Fe(SO4)2��6H2O [��Fe(NH4)2(SO4)2��6H2O]��
Fe(SCN)3����3���а�ɫ��״�������ɣ�Ѹ�ٱ�ɻ���ɫ�����ձ�ɺ��ɫ�������д����̼�����ζ�������ɣ�������ʹʪ��ĺ�ɫʯ����ֽ�������������ɣ�����4��(NH4)2Fe(SO4)2��6H2O [��Fe(NH4)2(SO4)2��6H2O]��
�����������������������KSCN��Һ��Һ���Ժ�ɫ������������⣬��Һ�Ժ�ɫ��˵��ԭ��Һ�к���Fe2�������������ᣬ�ټ���BaCl2��Һ�����ְ�ɫ������˵��ԭ��Һ�к���SO42�������������ƶϣ�D��EΪO��S��A��B����10���ӵ������ӣ���A����������E��1�����ӣ��Ƴ�AΪN��EΪO��DΪS��BΪH��A��B�γ�10���ӵ�������ΪNH4������1����������������ʵ����֤��ԭ��Һ�к���SO42����(2)���ù��������ǿ�����ԣ���Fe2��������Fe3���������ӷ�Ӧ����ʽΪH2O2+2Fe2++2H+==2H2O+2Fe3+��Fe3����SCN��������Ϸ�Ӧ��Fe3++3SCN-![]() Fe(SCN)3����3��ʵ�����м���NaOH��Һ���ȷ���Fe2����2OH��=Fe(OH)2�������ְ�ɫ��״������4Fe(OH)2��O2��2H2O=4Fe(OH)3�������ֺ��ɫ�����������μ��������ƣ�OH����NH4��
Fe(SCN)3����3��ʵ�����м���NaOH��Һ���ȷ���Fe2����2OH��=Fe(OH)2�������ְ�ɫ��״������4Fe(OH)2��O2��2H2O=4Fe(OH)3�������ֺ��ɫ�����������μ��������ƣ�OH����NH4��![]() NH3����H2O���д̼�����ζ����������а�ɫ��״�������ɣ�Ѹ�ٱ�ɻ���ɫ�����ձ�ɺ��ɫ�������д����̼�����ζ�������ɣ�������ʹʪ��ĺ�ɫʯ����ֽ�������������ɣ�����4�����ݻ��ϼ۵Ĵ�����Ϊ0��ȷ�ϲ����ᾧˮ�Ļ�ѧʽΪ(NH4)2Fe(SO4)2������Ħ������Ϊ392g��mol��1�����1mol�ᾧˮ�����к���6mol�ᾧˮ������ѧʽΪ��(NH4)2Fe(SO4)2��6H2O��
NH3����H2O���д̼�����ζ����������а�ɫ��״�������ɣ�Ѹ�ٱ�ɻ���ɫ�����ձ�ɺ��ɫ�������д����̼�����ζ�������ɣ�������ʹʪ��ĺ�ɫʯ����ֽ�������������ɣ�����4�����ݻ��ϼ۵Ĵ�����Ϊ0��ȷ�ϲ����ᾧˮ�Ļ�ѧʽΪ(NH4)2Fe(SO4)2������Ħ������Ϊ392g��mol��1�����1mol�ᾧˮ�����к���6mol�ᾧˮ������ѧʽΪ��(NH4)2Fe(SO4)2��6H2O��

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�