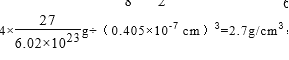题目内容
【题目】[化学——选修5物质结构与性质]
硼及其化合物在工业上有许多用途。工业上以铁硼矿为原料制备硼酸,铁硼矿含有Mg、Fe、Ca、Al、B、O等多种元素,它的主要成分为Mg2B2O5·H2O和Fe3O4。
(1)基态铁原子的外围电子层排布为 ,该元素位于元素周期表中的第 族,在水溶液中常以Fe2+、Fe3+的形式存在,其中 更稳定。
(2)以硼酸为原料可制得NaBH4, B原子的杂化方式为 。
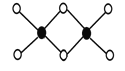
(3)工业上冶炼铝不用氯化铝,因为氯化铝易升华,其双聚物Al2Cl6结构如图所示。1mol该分子中含 个配位键,该分子 (填“是”或“不是”)平面型分子。
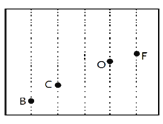
(4)依据第二周期元素第一电离能的变化规律,参照图中B、C、O、F元素的位置,用小黑点表示N元素的相对位置。
(5)Al单质为面心立方晶体,其晶体参数a=0.405nm,列式表示Al单质的密度: g·cm-3。
【答案】(15分)(1)3d64s2 (2分) Ⅷ(1分) Fe3+ (1分)
(2)SP3(2分) (3)2NA (2分) 不是 (2分)
(4)如右图所示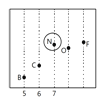 (2分)
(2分)
(5)ρ=![]() (3分)
(3分)
【解析】试题分析:(1)Fe元素原子核外电子数为26,根据能量最低原理,其价电子排布式为3d64s2,在周期表中位于第Ⅷ族,Fe3+离子3d为半满稳定状态,能量较低,比较稳定;故答案为:3d64s2;Ⅷ;Fe3+;(2)NaBH4中B原子价层电子对数为4+(3+1-1×4)/2=4,杂化轨道数目为4,其杂化方式为:sp3,故答案为:sp3;(3)Al2Cl6结构中黑色球为Al原子、白色球为Cl原子,Al原子与Cl原子之间形成3个共价键、1个配位键,Al原子杂化轨道数目为4,1mol该分子中含2NA个配位键,该分子不是平面型分子,故答案为:2NA;否;(4)同周期随原子序数增大,元素第一电离能呈增大趋势,氮元素原子2p能级为半满稳定状态,第一电离能高于同周期相邻元素的,故第一电离能B<C<O<N,表示N元素的相对位置为: (5)Al单质为面心立方晶体,晶胞中Al原子数目为8/8+5/2=4,晶胞质量为4×27/(6.02×1023),其晶体参数a=0.405nm,则晶胞密度为
(5)Al单质为面心立方晶体,晶胞中Al原子数目为8/8+5/2=4,晶胞质量为4×27/(6.02×1023),其晶体参数a=0.405nm,则晶胞密度为