题目内容
【题目】某化学兴趣小组设计如下实验方案。将浓硫酸与铜片反应制备SO2并进行相关实验探究,实验装置如下图所示:
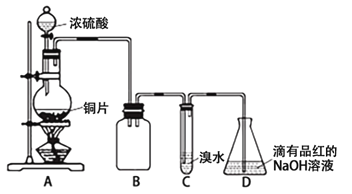
请回答下列问题:
(1)装置B的作用是 。
(2)设计装置C的目的是验证SO2的 性,装置C中发生反应的离子方程式是 。装置D中NaOH全部转化为NaHSO3的标志是 。
(3)向NaHSO3溶液中加入NaClO溶液时,反应有三种可能的情况:
I.HSO3-与ClO-恰好反应
Ⅱ.NaClO不足
Ⅲ.NaClO过量
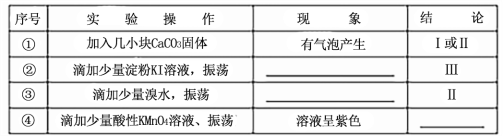
甲同学分别取上述混合溶液于试管中,通过下列实验确定该反应属于哪一种情况,请完成下表:(已知酸性:H2SO3>H2CO3>HClO)
(4)请设计简单实验证明:室温下HSO3-的电离平衡常数Ka与水解平衡常数Kb的相对大小: 。
【答案】(14分)
(1)防倒吸(或安全瓶)(1分)
(2)还原(1分);SO2 + Br2 + 2H2O === 4H+ + SO42- + 2Br- (2分)
溶液由红色变为无色 (2分)
(3)②溶液变为蓝色 (2分) ③溴水褪色(2分)
④Ⅰ或 Ⅲ(2分,仅填其中1个得1分)
[提示:发生的反应为 HSO3-+ClO-=== H++SO42-+Cl-]
(4)常温下,用pH试纸(或pH计)测定NaHSO3溶液的pH,若pH<7,则Ka>Kb ;若 pH>7,则Ka<Kb (2分)(其它合理答案也可给分)
【解析】
试题分析:由图可知,A中发生Cu与浓硫酸的反应生成二氧化硫,B作安全瓶,可防止倒吸,C中发生SO2+Br2+2H2O=H2SO4+2HBr,D中NaOH溶液吸收尾气,
(1)装置B的作用是防倒吸(或安全瓶),故答案为:防倒吸(或安全瓶);
(2)C中发生的反应中S元素的化合价升高,则设计装置C的目的是验证SO2的还原性,装置C中发生反应的离子方程式是SO2+Br2+2H2O=4H++SO42-+2Br-.装置D中NaOH全部转化为NaHSO3时碱性降低,装置D中NaOH全部转化为NaHSO3的标志是溶液由红色变为无色,
故答案为:还原;SO2+Br2+2H2O=4H++SO42-+2Br-;溶液由红色变为无色;
(3)②NaClO可氧化KI,则观察到溶液变为蓝色;
③溴水可氧化HSO3-,则观察到溴水褪色,
④HSO3-与高锰酸钾可发生氧化还原反应,由溶液为紫色可知,不存在HSO3-,则I或Ⅲ成立,
故答案为:
序号 | 实 验操作 | 现 象 | 结 论 |
① | 加几小块CaCO3固体 | 有气泡产生 | I或Ⅱ |
② | 滴加少量淀粉KI溶液,振荡 | 溶液变为蓝色 | Ⅲ |
③ | 滴加少量溴水,振荡 | 溴水褪色 | Ⅱ |
④ | 滴加少量酸性KMn04溶液、振荡 | 溶液为紫色 | I或Ⅲ |
(4)电离显酸性,水解显碱性,则测定pH即可,则设计实验为常温下,用pH试纸(或pH计)测定NaHS03溶液的pH,若pH<7,则Ka>Kb,若pH>7,则Ka<Kb,
故答案为:常温下,用pH试纸(或pH计)测定NaHS03溶液的pH,若pH<7,则Ka>Kb,若pH>7,则Ka<Kb。