题目内容
【题目】Ⅰ.在密闭容器中进行下列反应:CO2(g)+C(s)![]() 2CO(g) ΔH>0,达到平衡后,若改变下列条件,则平衡如何移动?(填“向左移动”、“向右移动”或“不移动”)
2CO(g) ΔH>0,达到平衡后,若改变下列条件,则平衡如何移动?(填“向左移动”、“向右移动”或“不移动”)
(1)增加C(s),平衡___。
(2)减小密闭容器容积,保持温度不变,则平衡___。
(3)通入N2,保持密闭容器容积和温度不变,则平衡__。
(4)保持密闭容器容积不变,升高温度,则平衡__。
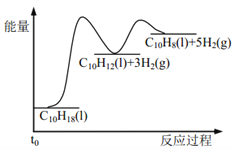
Ⅱ.在一密闭容器中发生下列反应:N2(g)+3H2(g)![]() 2NH3(g) ΔH<0,如图是某一时间段反应速率与反应进程的关系曲线图。
2NH3(g) ΔH<0,如图是某一时间段反应速率与反应进程的关系曲线图。
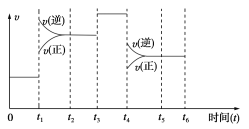
下列时间段中,氨的百分含量最高的是(_____)
A.0~t1 B.t2~t3
C.t3~t4 D.t4~t5
【答案】不移动 向左移动 不移动 向右移动 A
【解析】
Ⅰ.在密闭容器中进行下列反应:CO2(g)+C(s)![]() 2CO(g) ΔH>0,
2CO(g) ΔH>0,
此反应的特点是:反应物气体分子数小于生成物气体分子数,正反应为吸热反应。
(1)增加C(s),气体的浓度不变,平衡不受影响;
(2)减小密闭容器容积,也就是加压,保持温度不变,则平衡向气体分子数减小的方向移动;
(3)通入N2,保持密闭容器容积和温度不变,对气体的浓度不产生影响,平衡不受影响;
(4)保持密闭容器容积不变,升高温度,则平衡向吸热反应方向移动。
Ⅱ.从图中可以看出,两次改变条件,都是逆反应速率大,也就是平衡都逆向移动,氨的百分含量都在减小。
Ⅰ.在密闭容器中进行下列反应:CO2(g)+C(s)![]() 2CO(g) ΔH>0,
2CO(g) ΔH>0,
此反应的特点是:反应物气体分子数小于生成物气体分子数,正反应为吸热反应。
(1)增加C(s),但并未改变气体的浓度,平衡不受影响;答案为:不移动;
(2)减小密闭容器容积,也就是加压,保持温度不变,则平衡向气体分子数减小的方向移动,即向左移动;答案为:向左移动;
(3)通入N2,保持密闭容器容积和温度不变,对气体的浓度不产生影响,平衡不受影响;答案为:平衡不移动;
(4)保持密闭容器容积不变,升高温度,则平衡向吸热反应方向移动,即向右移动;答案为:向右移动。
Ⅱ.从图中可以看出,两次改变条件,都是逆反应速率大,也就是平衡都逆向移动,氨的百分含量都在减小,所以0~t1,氨的百分含量最高。答案为:0~t1。

【题目】Y、Z、W、R、M五种元素,位于元素周期表的前四周期,它们的核电荷数依次增大,有如下信息:
元素 | 相关信息 |
Y | 原子核外有6个不同运动状态的电子 |
Z | 非金属元素,基态原子的s轨道的电子总数与p轨道的电子总数相同 |
W | 主族元素,与Z原子的价电子数相同 |
R | 价层电子排布式为3d64s2 |
M | ⅠB族,其单质常用作导线 |
请回答下列问题(Y、Z、W、R、M用所对应的元素符号表示):
(1)Z、W元素相比,第一电离能较大的是_____________________,M2+的核外电子排布式为________________________。
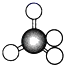
(2)写出两个与YZ2互为等电子体的化学式_________________ 。
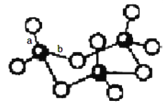
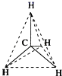
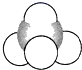
(3)WZ2分子中W原子价层电子对数是_____________对,WZ2的VSEPR 模型名称为_______________,WZ3气态为单分子,该分子中W原子的杂化轨道类型为__________________;WZ3的三聚体环状结构如图所示,该结构中W原子的杂化轨道类型为__________;该结构中W-Z键长有两类,一类键长约140pm,另一类键长约为160pm,较短的键为___________(填图中字母) ,该分子中含有______个σ键。