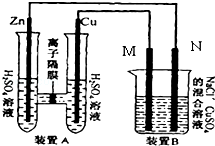
��Ŀ����
����Ŀ����������װ�����һ��ʵ�飬�ԲⶨSO2ת��ΪSO3��ת���ʣ�
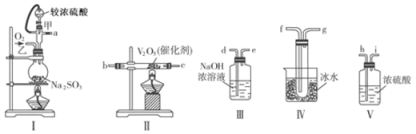
��1��д��I����70%�����������������ȡ��������Ļ�ѧ����ʽ ��
��2����Щװ�õ�����˳����������ҵķ�����a�� �� �� �� �� �� �� ��d������ӿڵı�ţ���
��3�����Ҵ�����ͨ��O2��ΪʹSO2�нϸߵ�ת���ʣ�ʵ��ʱ��������Ũ�������������ȴ������Ⱥ�˳���� ��II�з����Ļ�ѧ����ʽΪ ��
��4�������۲쵽�������� ��
��5���������ô�������ƿʱ��SO2��ת���ʻ� ���������������������������С����
���𰸡���1��Na2SO3+H2SO4(Ũ)=Na2SO4+SO2��+H2O����2��h��i��b��c��f��g��d��
��3���ȼ���V2O5��������Ũ���2SO2+O2![]() 2SO3��
2SO3��
��4���а�ɫ����(�����)���ɣ�
��5������
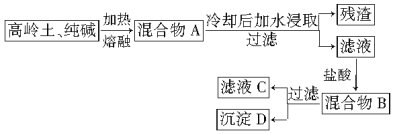
��������
�����������1���������ԣ� H2SO4 >H2SO3������70%��Ũ������Na2SO3�ᷢ�����ֽⷴӦ������SO2���壬��Ӧ�Ļ�ѧ����ʽ�ǣ�Na2SO3+H2SO4(Ũ)=Na2SO4+SO2��+H2O��
��2�������Һ�з�Ӧ���������л���ˮ���������Բ������������Ⱦ�������װ�â�Ȼ���ٽ��ж�����������Ĵ�����������װ�â�Ȼ�����ռ�SO3��SO3���۵���16.8�棬�е���44.8�棬����ѡ��װ�â�������ȴ��ʹ�������������������룬����ڢ�������δ��Ӧ��SO2��Ҫ�Ʊ����������������������ʡ��ռ��������������õ���װ��Ϊ�������巢��װ�ã�������װ�ã���Ϊ�������������װ�ã����ռ�װ�ã���β������װ�ã�������ȷ��˳��Ϊ��a h i b c fg d��
��3��Ϊ��֤�����Ķ��������ܶ��ת��Ϊ��������Ӧ�ȼ���V2O5��������Ũ���ᣬ����SO2��O2����������SO3��������Ӧ�Ļ�ѧ����ʽ��2SO2+O2![]() 2SO3��
2SO3��
��4��װ��IV����������ȴ�����������壬ʹ֮���Һ̬���̬���Ӷ��ռ��õ������������Կ����ڢ�����������ɫ�����ɫ�����壨����壩���ɣ�
��5�������ȣ����ɶ�������Ͽ죬���ܳ�ַ�Ӧ����SO2��ת���ʻ���С��

 Ӧ������ҵ��ϵ�д�
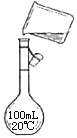
Ӧ������ҵ��ϵ�д�����Ŀ����ʵ�������������ƹ�������1.0 mol��L��1��NaOH��Һ250mL���ش��������⣺
��1��ʵ��������������ƽ��ҩ�ס��ձ�����������(��Ͳ)�� ��
��2��ʵ�鲽�裺�����㣺�����������ܽ⣬����Һ����ϴ�ӣ��� ��ҡ�ȡ����������Ȼ��Ƶ�����Ϊ g��
��3�����в���ʹ������Һ��Ũ��ƫ�����________��
A��������ƽ�����̷���ֽ����NaOH |
B��δϴ���ܽ�NaOH���ձ� |
C���ܽ��δ��ȴ������ת�Ƶ�����ƿ�� |
D������ʱ���ӿ̶��� |
E��ҡ�ȣ����ú���Һ�治���̶��ߣ��ټ�ˮ���̶���
F������ƿδ���T����������Һ
��4����ͼ��ʵ�鲽������ʾ��ͼ��ͼ�еĴ�����