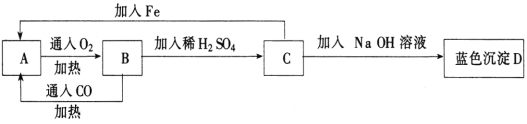
题目内容
【题目】(1)某学生实验小组用50mL0.50molL﹣1的盐酸与50mL0.50molL﹣1的NaOH溶液在右图所示的装置中进行中和反应反应热的测定
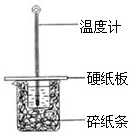
①图中装置缺少的一种仪器,该仪器名称为 .
②将反应混合液的 温度记为反应的终止温度.
③下列说法正确的是 .
A.小烧杯内残留有水,会使测得的反应热数值偏小
B.可用相同浓度和体积的醋酸代替稀盐酸溶液进行实验
C.烧杯间填满碎纸条的作用是固定小烧杯
D.酸、碱混合时,应把量筒中的溶液缓缓倒入烧杯的溶液中,以防液体外溅.
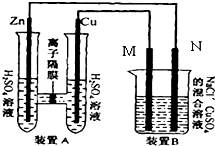
(2)如图装置B中是浓度均为0.1mol/L的NaCl、CuSO4混合溶液,溶液体积为500ml,M、N均为石墨电极,当装置A中Zn棒质量减少6.5g时,N上质量增加 g;此时,所有电极上总共收集到的气体的总体积为 L(换算成标准状况下的体积).
【答案】(1)①环形玻璃搅拌棒;②最高温度;③A
(2)3.2;4.76
【解析】
试题分析:(1)①根据量热计的构造可知该装置的缺少仪器是环形玻璃搅拌器;②将反应混合液的最高温度温度记为反应的终止温度.(2)A、小烧杯内残留有水,会导致混合液的体积变大,混合液温度降低,温度差减小,测得的反应热数值偏小,故A正确;
B、醋酸为弱酸,电离过程为吸热过程不能用醋酸代替盐酸,故B错误;
C、烧杯间填满碎纸条的作用是保温,减少热量的散失,故C错误;
D、酸、碱混合时,应把量筒中的溶液快速倒入烧杯的溶液中,以防热量的散失,D错误;(2)电解氯化钠和硫酸铜混合溶液时,阳极上氯离子放电生成氯气,阴极上铜离子放电生成铜,串联电路中转移电子数相等,所以当装置A中Zn棒质量减少6.5g时,![]() =6.4g,实际上溶液中铜离子的质量=0.1mol/L×0.5L×64g/mol=3.2g,所以析出铜的质量是3.2g;当装置A中Zn棒质量减少6.5g时,装置中转移的电子数为:
=6.4g,实际上溶液中铜离子的质量=0.1mol/L×0.5L×64g/mol=3.2g,所以析出铜的质量是3.2g;当装置A中Zn棒质量减少6.5g时,装置中转移的电子数为:![]() =0.2mol,B中NaCl、CuSO4的物质的量都为n=cv=0.1mol/L×0.5L=0.05mol,
=0.2mol,B中NaCl、CuSO4的物质的量都为n=cv=0.1mol/L×0.5L=0.05mol,
A装置原电池中,易失电子的金属锌作负极,铜作正极,正极上氢离子得电子发生还原反应而生成氢气,电极反应式为:2H++2e-=H2↑,生成的氢气的物质的量为0.1mol,
B装置中阳极上氯离子放电生成氯气2Cl--2e-=Cl2↑、4OH--4e-=O2↑+2H2O,生成氯气0.025mol,根据得失电子守恒,生成氧气![]() =0.0375mol,阴极发生Cu2++2e-=Cu、生成铜0.05mol,根据得失电子守恒,2H++2e-=H2↑,
=0.0375mol,阴极发生Cu2++2e-=Cu、生成铜0.05mol,根据得失电子守恒,2H++2e-=H2↑,![]() =0.05mol,
=0.05mol,
所以生成气体总的物质的量为:0.1mol+0.025mol+0.0375mol+0.05mol=0.2125mol,总体积为v=n×vm=0.2125mol×22.4L/mol=4.76L。

【题目】化学在生活中有着广泛的应用,下列对应关系错误的是
化学性质 | 实际应用 | |
A. | Al2(SO4)3和小苏打反应 | 泡沫灭火器灭火 |
B. | 铁比铜金属性强 | FeCl3腐蚀Cu刻制印刷电路板 |
C. | 次氯酸盐具有氧化性 | 漂白粉漂白织物 |
D. | HF与SiO2反应 | 氢氟酸在玻璃器皿上刻蚀标记 |
【题目】实验室里有四个药品橱,已经存放以下列试剂:
药品橱 | 甲橱 | 乙橱 | 丙橱 | 丁橱 |
药品 | 醋酸、乙醇、苯 | 明矾、CuSO45H2O、MgCl2 | 白磷、硫黄、碳 | 镁条、锌粒、铜 |
实验室新购进一些碘化钾,应该将这些碘化钾放在( )
A. 甲橱 B. 乙橱 C. 丙橱 D. 丁橱