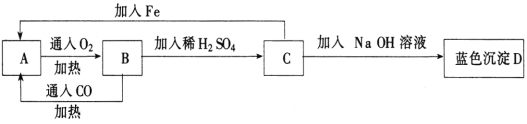
题目内容
【题目】分实验室用氢氧化钠固体配制1.0 mol·L-1的NaOH溶液250mL,回答下列问题:
(1)实验仪器:托盘天平、药匙、烧杯、玻璃棒、(量筒)、 。
(2)实验步骤:①计算:②称量,③溶解,④移液,⑤洗涤,⑥ ⑦摇匀。称量所需氯化钠的质量为 g。
(3)下列操作使所配溶液的浓度偏大的有________;
A.托盘天平的托盘放上纸称量NaOH |
B.未洗涤溶解NaOH的烧杯 |
C.溶解后未冷却就立即转移到容量瓶中 |
D.定容时俯视刻度线 |
E.摇匀,静置后发现液面不到刻度线,再加水至刻度线
F.容量瓶未干燥即用来配制溶液
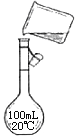
(4)右图是实验步骤④的示意图,图中的错误是
【答案】(1) 250mL容量瓶,胶头滴管 ;
(2) 定容; 10.0,(3)C、D
(4)未用玻璃棒引流;未使用250 mL容量瓶
【解析】试题分析:(1) 配制一定物质的量浓度溶液的一般步骤:计算、称量、溶解、移液、洗涤、定容,用到的仪器:托盘天平、药匙、烧杯、玻璃棒、250mL容量瓶、胶头滴管,所以还缺少的仪器:250mL容量瓶,胶头滴管,故答案为:250mL容量瓶,胶头滴管;
(2) 配制1.0 mol·L-1的NaOH溶液250mL,依据配制步骤:计算、称量、溶解冷却、移液、洗涤、定容、摇匀装瓶,应该选用250mL容量瓶,所以必须配置250mL溶液,则需要m(NaOH)=cVM=1.0mol/L×0.25L×40g/mol=10.0g,故答案为:定容;10.0;
(3)A.托盘天平的托盘放上纸称量NaOH,氢氧化钠吸收空气中的水蒸气,导致溶质的物质的量偏小,浓度偏小,错误;B.未洗涤溶解NaOH的烧杯,导致溶质的物质的量偏小,浓度偏小,错误;C.溶解后未冷却就立即转移到容量瓶中,导致溶液的体积偏小,浓度偏大,正确;D.定容时俯视刻度线,导致溶液的体积偏小,浓度偏大,正确;E.摇匀,静置后发现液面不到刻度线,再加水至刻度线,导致溶液的体积偏大,浓度偏小,错误;F.容量瓶未干燥即用来配制溶液,对实验结果无影响,错误;故选CD;
(4)根据图示,图中的错误有未用玻璃棒引流;未使用250 mL容量瓶,故答案为:未用玻璃棒引流;未使用250 mL容量瓶。

【题目】化学在生活中有着广泛的应用,下列对应关系错误的是
化学性质 | 实际应用 | |
A. | Al2(SO4)3和小苏打反应 | 泡沫灭火器灭火 |
B. | 铁比铜金属性强 | FeCl3腐蚀Cu刻制印刷电路板 |
C. | 次氯酸盐具有氧化性 | 漂白粉漂白织物 |
D. | HF与SiO2反应 | 氢氟酸在玻璃器皿上刻蚀标记 |